
23 11 |
1 1 |
2 1 |
3 1 |
1 1 |
2 1 |
3 1 |
1 1 |
2 1 |
3 1 |
 ,
, ;
; ,
, .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、高温时纯碱和石英发生反应Na2CO3+SiO2═Na2SiO3+CO2↑,所以硅酸酸性比碳酸酸性强 |
| B、硅胶可用作干燥剂、吸附剂、催化剂载体 |
| C、石英坩埚、光导纤维、太阳能电池都是二氧化硅的用途 |
| D、自然界中存在储量丰富的单质硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
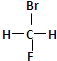 和
和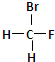 ②1H-、2H、3H+、D2 ③淀粉和纤维素 ④
②1H-、2H、3H+、D2 ③淀粉和纤维素 ④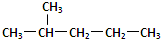 和
和 ⑤16O2、18O3 ⑥235U、238U
⑤16O2、18O3 ⑥235U、238U查看答案和解析>>
科目:高中化学 来源: 题型:
| H | + |
| H | + |
| H | + |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多.
2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A、实验室用氯化铵与消石灰制氨气:NH4++OH-
| ||||
| B、将CO2通入BaCl2溶液中:H2O+CO2+Ba2+═BaCO3↓+2H+ | ||||
| C、少量SO2通入加漂白粉的水溶液中:SO2+H2O+Ca2++3ClO-═CaSO4↓+2HClO+Cl- | ||||
D、用H2还原MgO:H2+MgO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯的分子是环状结构,属于烷烃 |
B、 表示苯的分子结构,其中含有碳碳单键、双键 表示苯的分子结构,其中含有碳碳单键、双键 |
| C、苯的分子式为C6H6,分子中碳原子远远没有饱和,因此,能与溴水反应 |
| D、苯不使酸性高锰酸钾褪色,说明苯分子中不含碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、品红溶液中分别通入SO2和Cl2,品红均褪色 |
| B、浓硫酸和浓盐酸长期暴露在空气中浓度都会降低 |
| C、溴水分别滴入植物油和裂化汽油中,溴水均褪色 |
| D、鸡蛋白溶液中分别加入NaCl溶液和CuCl2溶液,均有固体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、今夏,全国不少地区出现了严重的旱情,缓解旱情的措施之一是用碘化银进行人工增雨 |
| B、合金材料中可能含有非金属元素 |
| C、利用红外光谱仪能确定有机物的某些官能团 |
| D、人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com