
【题目】为解决燃料危机和温室效应,科学家尝试用CO2与CH4制取CO和H2。
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+206.1kJ·mol-1
CO(g)+3H2(g) ΔH1=+206.1kJ·mol-1
②2H2(g)+CO(g)![]() CH3OH(1) ΔH2=-128.3kJ·mol-1
CH3OH(1) ΔH2=-128.3kJ·mol-1
③2H2(g)+O2(g)![]() 2H2O(g) ΔH3=-483.6kJ·mol-1
2H2O(g) ΔH3=-483.6kJ·mol-1
④2CH4(g)+O2(g)![]() 2CH3OH(1) △H4
2CH3OH(1) △H4
在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇在低温下能否自发进行____(填“能”或“否”),理由是____。
(2)某温度下,CH4(g)+H2O(g)![]() CO(g)+3H2(g),将1molCH4(g)和1molH2O(g)加入100kPa的密闭容器中,正反应速率v正=k正×p(CH4)×p(H2O),逆反应速率v逆=k逆×p(CO)×p3(H2),p为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=____(以k正、k逆表示)。若k正=4.4×104kPa-1·s-1,当CH4分解20%时,v正=____kPa·s-1(保留两位有效数字)。
CO(g)+3H2(g),将1molCH4(g)和1molH2O(g)加入100kPa的密闭容器中,正反应速率v正=k正×p(CH4)×p(H2O),逆反应速率v逆=k逆×p(CO)×p3(H2),p为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=____(以k正、k逆表示)。若k正=4.4×104kPa-1·s-1,当CH4分解20%时,v正=____kPa·s-1(保留两位有效数字)。
(3)CO2用于生产乙烯,已知:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) ΔH=QkJ/mol。
CH2=CH2(g)+4H2O(g) ΔH=QkJ/mol。
一定条件下,按不同的投料比![]() 向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。

①X1____X2(填“>”或“<”,后同),Q____0。
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为_____。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-)∶c(HCO3-)=____。
[常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
②欲用5LNa2CO3溶液将23.3gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为____。[已知:常温下Ksp(BaSO4)=1×10-7、Ksp(BaCO3)=2.5×10-6]。(忽略溶液体积的变化)
【答案】能 2CH4(g)+O2(g)![]() 2CH3OH(1) △H4=-328.0kJ·mol-1<0,根据方程式可判断反应的△S<0,故在低温时能自发进行
2CH3OH(1) △H4=-328.0kJ·mol-1<0,根据方程式可判断反应的△S<0,故在低温时能自发进行 ![]() 4.9×107 kPa·s-1 > < KA>KB=KC 1∶2 0.52mol/L
4.9×107 kPa·s-1 > < KA>KB=KC 1∶2 0.52mol/L
【解析】
(1)将①②③式作如下处理得到④式:①×2+②×2+③=④,所以△H4=2ΔH1+2ΔH2+ΔH3=2×(+206.1kJ·mol-1)-2×(-128.3kJ·mol-1)- 483.6kJ·mol-1=-328.2 kJ·mol-1,所以2CH4(g)+O2(g)![]() 2CH3OH(1)的△H<0,且该反应是气体分子数减少的反应,熵减,
2CH3OH(1)的△H<0,且该反应是气体分子数减少的反应,熵减,![]() <0,当ΔH-TΔS<0时,反应能自发进行,即T比较小的时候才能满足,所以低温时,能自发进行,故答案为:能;2CH4(g)+O2(g)
<0,当ΔH-TΔS<0时,反应能自发进行,即T比较小的时候才能满足,所以低温时,能自发进行,故答案为:能;2CH4(g)+O2(g)![]() 2CH3OH(1) △H4=-328.0kJ·mol-1<0,根据方程式可判断反应的△S<0,故在低温时能自发进行;
2CH3OH(1) △H4=-328.0kJ·mol-1<0,根据方程式可判断反应的△S<0,故在低温时能自发进行;
(2)因为正反应速率v正=k正×p(CH4)×p(H2O),逆反应速率v逆=k逆×p(CO)×p3(H2),所以p(CH4)×p(H2O)=![]() ,p(CO)×p3(H2)=
,p(CO)×p3(H2)=![]() ,由CH4(g)+H2O(g)
,由CH4(g)+H2O(g)![]() CO(g)+3H2(g)可知,Kp=
CO(g)+3H2(g)可知,Kp=![]() =
=![]() =
=![]() ,平衡时:
,平衡时:![]()
![]() ,所以Kp=
,所以Kp=![]() ,将1molCH4(g)和1molH2O(g)加入100kPa的密闭容器中,CH4分解20%时有
,将1molCH4(g)和1molH2O(g)加入100kPa的密闭容器中,CH4分解20%时有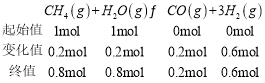 ,总压=100 kPa,所以CH4分解20%时p(CH4)=100 kPa×
,总压=100 kPa,所以CH4分解20%时p(CH4)=100 kPa×![]() =
=![]() kPa,p(H2O)= 100 kPa×
kPa,p(H2O)= 100 kPa×![]() =
=![]() kPa,v正=k正×p(CH4)×p(H2O)=4.4×104kPa-1·s-1×
kPa,v正=k正×p(CH4)×p(H2O)=4.4×104kPa-1·s-1×![]() kPa×
kPa×![]() kPa≈4.9×107 kPa·s-1,故答案为:
kPa≈4.9×107 kPa·s-1,故答案为:![]() ;4.9×107 kPa·s-1;
;4.9×107 kPa·s-1;
(3)①当其他条件一定时,充入的H2量越多,CO2转化率越高,对应的X越大,则X1>X2,在其它条件不变时,结合图象可知:温度升高,CO2的转化率降低,可推知该反应的正反应是放热反应,则Q<0,故答案为:﹥;﹤;
②结合图象可知该反应的正反应为放热反应,温度升高,平衡逆向移动,该反应的化学平衡常数减小,而且化学平衡常数只与温度有关,根据图象知A点的温度低于B、C两点,而且B、C两点温度相同,则三点对应的平衡常数的大小关系为:KA>KB=KC,故答案为:KA>KB=KC;
(4)①由题意pH=10,可计算c(H+)=1×1010mol/L,由HCO![]() CO
CO![]() +H+可得:Ka2=
+H+可得:Ka2=![]() =5×1011,所以
=5×1011,所以![]() =1∶2,故答案为:1∶2;
=1∶2,故答案为:1∶2;
②设至少需要物质的量浓度为xmol/L的Na2CO3溶液,当BaSO4完全溶解后,23.3gBaSO4的物质的量为n(BaSO4)=23.3g÷233g/mol=0.1mol,所得5L溶液中c(SO![]() )=0.1mol÷5L=0.02mol/L,此时溶液中c(CO
)=0.1mol÷5L=0.02mol/L,此时溶液中c(CO![]() )=(x-0.02)mol/L,由BaSO4+CO
)=(x-0.02)mol/L,由BaSO4+CO![]() =BaCO3+SO
=BaCO3+SO![]() 可知,此反应的化学平衡常数K=
可知,此反应的化学平衡常数K=![]() =0.04=
=0.04=![]() ;②设至少需要物质的量浓度为xmol/L的Na2CO3溶液,当BaSO4完全溶解后,所得5L溶液中c(SO
;②设至少需要物质的量浓度为xmol/L的Na2CO3溶液,当BaSO4完全溶解后,所得5L溶液中c(SO![]() )=0.02mol/L,此时溶液中c(CO
)=0.02mol/L,此时溶液中c(CO![]() )=(x-0.02)mol/L,由BaSO4+CO
)=(x-0.02)mol/L,由BaSO4+CO![]() =BaCO3+SO
=BaCO3+SO![]() 可知,此反应的化学平衡常数K=
可知,此反应的化学平衡常数K=![]() =0.04=
=0.04=![]() ,解得x=0.52mol/L,故答案为:0.52 mol/L。
,解得x=0.52mol/L,故答案为:0.52 mol/L。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH3COOCH2CH3 与CH3CH2COOCH3 中均含有甲基、乙基和酯基,为同一种物质
B.![]() 和
和 ![]() 为同一物质
为同一物质
C.CH3CH2CH2CH2CH3 和CH3CH2CH(CH3)2 互为同素异形体
D.CH3CH2OH 和 CH2OHCHOHCH2OH 具有相同的官能团,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯通入溴水中发生的化学反应方程式_______________________________________。实验室制取乙烯的化学反应方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S=Na2S2O3。常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O35H2O于4045℃熔化,48℃分解:Na2S2O3 易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线 如图所示。

I.现按如下方法制备Na2S2O35H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按如下图示安装好装置。
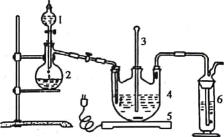
(1)仪器2的名称为__________,装置6中可加入________。
A. BaCl2溶液 B.浓 H2SO4 C.酸性KMnO4溶液 D. NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二 氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2═Na2SO3+CO2 ②Na2S+SO2+H2O═Na2SO3+H2S
③2H2S+SO2═3S↓+2H2O ④Na2SO3+S![]() Na2S2O3
Na2S2O3
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:______(用文字和相关离子方程式表示)。
Ⅱ.分离Na2S2O35H2O并测定含量:

(3)为减少产品的损失,操作①为_______,操作②是抽滤、洗涤、干燥,其中洗涤操作是用______(填试剂名称)作洗涤剂。
(4)蒸发浓缩滤液,直至溶液呈微黄色浑浊为止。蒸发时要控制温度不宜过高,其原因是_______________。
(5)制得的粗产品中往往含有少量杂质。为了测定粗产品中Na2S2O35H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定杂质与酸性KMnO4溶液不反应)。 称取1.28g粗样品溶于水,用0.40mol/LKMnO4溶液(加入适量硫酸酸化)滴定,当溶液 中S2O32-全部被氧化时,消耗KMnO4溶液20.00mL。(5S2O32-+ 8MnO4-+14H+=8Mn2++l0SO42-+7H2O)
试回答:
①滴定终点时的颜色变化_______________。
②产品中Na2S2O35H2O的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四组物质中:A.![]() 和
和![]() B.
B. ![]() 和
和![]() C.
C.![]() 和
和![]() D.
D. ![]() 和
和![]() E.
E. ![]() 和
和![]() 。其中__________互为同位素;___________是同分异构体;___________是同系物。
。其中__________互为同位素;___________是同分异构体;___________是同系物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃A,分子式为C8H16,A在一定条件下被氧化只生成一种物质B。则符合上述条件的烃A有几种(考虑顺反异构)
已知:
A. 3 B. 4 C. 6 D. 8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______.
(2)BF3与一定量的水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力有______(填序号).
a.离子键b.共价键c.配位键d.氢键
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2﹣,不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为______ ,科学家推测胆矾结构示意图可简单表示如图:胆矾的化学式用配合物的形式表示为_____________________.

(4)第一电离能介于B、N之间的第二周期元素有______种.S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是_____

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com