
(13分)有机物F是有机合成工业中一种重要的中间体。以甲苯和丙烯为起始原料合成F的工艺流程如下:
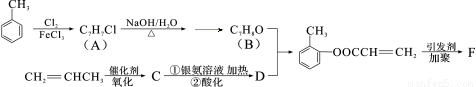
回答下列问题:
(1)化合物B中的含氧官能团名称是 。F的结构简式为 。
(2)写出C与银氨溶液共热的化学反应方程式: 。
(3)化合物D不能发生的反应有 (填序号)。
①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤水解反应
(4)B的含苯环结构的同分异构体还有 种,其中一种的核磁共振氢谱中出现4个峰且不与FeCl3溶液发生显色反应的是 (填结构简式)。
(13分)(1)(酚)羟基(1分);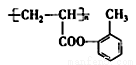 (2分);
(2分);
(2)CH2=CHCHO + 2Ag(NH3)2OH CH2=CHCOONH4 + 2Ag↓+ 3NH3 + H2O(3分);
CH2=CHCOONH4 + 2Ag↓+ 3NH3 + H2O(3分);
(3)③⑤(2分); (4)4(3分);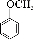 (2分)
(2分)
【解析】
试题分析:根据B与D反应的生成物结构简式可知,该反应是酯化反应,则B和D的结构简式分别是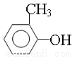 、CH2=CHCHCOOH,则C的结构简式是CH2=CHCHCHO,A的结构简式为
、CH2=CHCHCOOH,则C的结构简式是CH2=CHCHCHO,A的结构简式为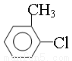 。则
。则
(1)根据以上分析可知化合物B中的含氧官能团名称是酚羟基。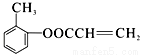 分子中含有碳碳双键,能发生加聚反应,则F的结构简式为
分子中含有碳碳双键,能发生加聚反应,则F的结构简式为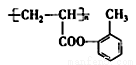 。
。
(2)C分子中含有醛基,因此C与银氨溶液共热的化学反应方程式为CH2=CHCHO + 2Ag(NH3)2OH CH2=CHCOONH4 + 2Ag↓+ 3NH3 + H2O;
CH2=CHCOONH4 + 2Ag↓+ 3NH3 + H2O;
(3)有机物D中含有碳碳双键和羧基,因此能发生加成反应、取代反应、氧化反应,不能发生消去反应和水解反应,答案选③⑤。
(4)B的含苯环结构的同分异构体还有4种,分别是苯甲醇、苯甲醚、对甲基苯酚、间甲基苯酚。其中一种的核磁共振氢谱中出现4个峰且不与FeCl3溶液发生显色反应的是苯甲醚,结构简式为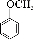 。
。
考点:考查有机物推断、有机物性质、官能团、同分异构体判断以及方程式书写等


科目:高中化学 来源:2015届宁夏高三年级第二次月考理综化学试卷(解析版) 题型:填空题
(13分)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为__________.
(2)写出该反应的化学方程式____________________________________________.
若反应中生成0.2 mol HNO3,转移的电子数目为________个.
(3) 三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F ,据题意推测 NF3、F2、NO三种气体中,氧化性由弱到强的顺序为____________________
(4)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现.你判断该气体泄漏时的现象是___________________________________________________.
(5)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有____________________________(填化学式).
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
下列有关化学用语的表示正确的是()
A.N2的电子式: 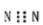 B. 甲烷分子的比例模型是
B. 甲烷分子的比例模型是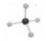
C. 硝基和二氧化氮两种粒子所含电子数相等 D. 甲基的电子式: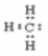
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三第三次理综考试化学试卷(解析版) 题型:填空题
(15分)硅基太阳电池需用化合物甲作钝化材料,甲的摩尔质量为140 g·mol-1,其中硅元素的质量分数为60%。已知1 molNH3与足量的化合物乙充分反应后可得到35 g 甲与6 g H2。工业上制乙的流程如下: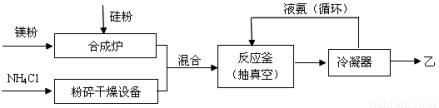 请回答下列问题:
请回答下列问题:
(1)乙的电子式是 ;比较热稳定性:乙_______NH3(填>,<或=)。
(2)NH3与足量的化合物乙反应制甲的化学方程式是 。
(3)合成炉内物质需在保护气氛下高温合成,下列气体可作保护气的有 (填字母编号)。
A.O2 B.H2 C.N2 D.CO2 E.Ar
(4)上述生产乙的过程中液氨的作用是______________________________________。
(5)甲与少量H2SO4溶液反应只得到H2SiO3和盐M两种产物,写出该反应的离子方程式 。请设计验证产物盐M的实验方案 。
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三第三次理综考试化学试卷(解析版) 题型:选择题
下列各反应对应的离子方程式正确的是( )
A.次氯酸钠溶液中通入过量二氧化硫ClO- + H2O + SO2 = HClO + HSO3-
B.向碳酸氢钠溶液中加入过量氢氧化钙溶液2HCO3-+ Ca2++2OH-= CaCO3↓+2H2O+CO32-
C.氢氧化钡溶液与硫酸溶液反应得到中性溶液Ba2++OH-+ H++SO42— = BaSO4↓+H2O
D.50 mL 1mol/L的NaOH溶液中通入0.03 mol H2S 5OH- + 3H2S = HS— + 2S2- + 5H2O
查看答案和解析>>
科目:高中化学 来源:2015届四川省资阳市高三一诊理综化学试卷(解析版) 题型:选择题
下列实验的操作、现象、结论均正确的是
选项 | 操作 | 结论 |
A | 用洁净的铂金丝沾取硫酸盐在酒精灯上灼烧,焰色为黄色 | 该硫酸盐一定含Na 一定不含K |
B | 二氧化硫通入Ba(NO3)2溶液有白色沉淀生成,试管口出现浅红棕色气体 | 酸性条件下NO |
C | 在淀粉的水解液中加入新制Cu(OH)2悬浊液加热,无红色沉淀 | 淀粉没有发生水解 |
D | 某试样溶液中加入少量稀盐酸,有白色沉淀生成 | 试样中一定含有Ag |
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵阳市高三“一诊”模拟考试理综化学试卷(解析版) 题型:填空题
(16分)草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
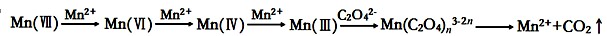
【提出假设】假设1: 该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3: K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是
【设计、完成实验】
(1)称取 g草酸晶体(H2C2O4·2H2O),配置500mL 0.10mol/L H2C2O4溶液。
① 在上述过程中必须用到的2种定量仪器是托盘天平和 。
② 下列操作会使所配溶液浓度偏低的是 (填下列选项的字母序号)。
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
(2)完成探究,记录数据
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪 色时间 (s) | |||
0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
1 | 30 | 20 | 30 | 20 |
| 18 |
2 | 30 | 20 | 30 | 20 | 水浴控制温度65℃ | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
4 | 30 | 20 | x | 20 | 加入5mL 0.10mol/L K2SO4溶液 | 18 |
则x = ,假设 成立
(3)由于KMnO4能氧化水中有机物等因素,配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,
则草酸溶液与酸性KMnO4溶液反应的离子方程式为: 。
上述实验中KMnO4溶液的物质的量浓度为
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵竹市高三上学期第二次月考化学试卷(解析版) 题型:选择题
已知单质铁溶于一定浓度的HNO3溶液中反应的离子方程式为:
aFe+bNO3﹣+cH+ ═ dFe2++fFe3++gNO↑+hN2O↑+kH2O,
化学计量数a~k均为正整数.则它们之间的关系错误的是
A.c=4g+10h B.a+c=d+f
C.2d+3f=3g+8h D.c﹣b=2d+3f
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:选择题
下列对一些实验事实的理论解释正确的是
| 实验事实 | 理论解释 |
A | SO2溶于水形成的溶液能导电 | SO2是电解质 |
B | 白磷为正四面体分子 | 白磷分子中P—P间的键角是109°28′ |
C | 1体积水可以溶解700体积氨气 | 氨是极性分子;可与水形成氢键;且与水反应 |
D | HF的沸点高于HCl | H—F的键长比H—Cl的键长短 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com