
| 反应阶段 | Ⅰ | Ⅱ | Ⅲ |
| 盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 产生气体 | 无气体 |
分析 (1)依据溶液稀释过程中所含溶质的物质的量不变计算需要浓盐酸的物质的量;
(2)第一阶段无气体生成说明盐酸滴入溶液中发生的是碳酸根离子和氢离子生成碳酸氢根离子的过程,氯化氢物质的量和碳酸钠物质的量相同,计算得到碳酸根离子的浓度;
解答 解:(1)配制0.10mol•L-1的稀盐酸250mL设需要浓盐酸的体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得:V×10.0mol/L=0.10mol/L×250mL,解得V=2.5mL;
故答案为:2.5mL;
(2)当加入10mL稀盐酸时,恰好把样品中的碳酸根离子完全转化为碳酸氢根离子,10mL稀盐酸的物质的量为0.010L×0.10mol/L=0.001mol;
设20.0mL样品溶液中碳酸根离子的物质的量为y则:
CO32-+H+?HCO3-
1 1
y 0.001mol
解得y=0.001mol,则样品中碳酸根离子物质的量浓度C=$\frac{0.001mol}{0.02L}$=0.05mol/L;
故答案为:0.05mol/L;
点评 本题考查了混合物反应的计算,明确每一阶段发生的反应实质为解答关键,注意掌握碳酸根离子、碳酸氢根离子与酸反应的离子方程式,题目难度中等.


科目:高中化学 来源: 题型:选择题
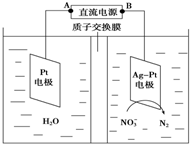
| A. | 铅蓄电池的B极为正极,电极材料为PbO2 | |
| B. | 铅蓄电池工作过程中负极质量增加 | |
| C. | 该电解池的阳极反应为:2 NO3-+6H2O-10e-═N2↑+12OH- | |
| D. | 若电解过程中转移10mol电子,则生成N2的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应时,生成0.1mol氧气,转移电子数为0.2NA | |
| B. | 2L 0.5mol•L-1亚硫酸溶液中,含有的H+离子数为2NA | |
| C. | 常温常压下,1mol氦气含有的原子数为2NA | |
| D. | 标准状况下,11.2L水含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
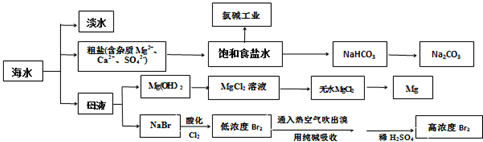
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ②③⑤⑥ | C. | ①④⑤⑦ | D. | ①②③⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质在水溶液中完全电离成阴、阳离子 | |
| B. | 在溶液中,导电能力强的电解质是强电解质 | |
| C. | 纯净的强电解质在液态时,有的导电,有的不导电 | |
| D. | 对同一弱电解质来说,当溶液的温度和浓度不同时,其导电能力也不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,取适量的碳酸钠溶液,向其中逐滴滴加盐酸,生成的CO2的物质的量与滴加盐酸的体积关系如图所示,其中b=2a.下列说法正确的是( )
常温下,取适量的碳酸钠溶液,向其中逐滴滴加盐酸,生成的CO2的物质的量与滴加盐酸的体积关系如图所示,其中b=2a.下列说法正确的是( )| A. | 点o溶液、点b溶液、点d溶液的pH都大于7 | |
| B. | 点b溶液中:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-) | |
| C. | 点o溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3) | |
| D. | 点a溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
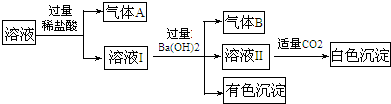
| A. | 气体B一定是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Al3+、Fe2+、NH4+、NO3- | |
| D. | 溶液中一定不存在大量的Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com