
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,基态镍原子M层上的未成对电子数为 。
(2)大阪大学近日宣布,有机太阳能固体电池效率突破5.3%,而高纯度C60是其“秘密武器”。C60的结构如图1,分子中碳原子轨道的杂化类型为 ;1 mol C60分子中π键的数目为 。
(3)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如下图2。该结构中,碳氮之间的共价键类型有 (按原子轨道重叠方式填写共价键的类型),请在下图2中用箭头表示出配位键。

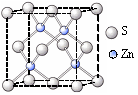
图1 图2 图3
(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
①第一电离能:As Se(填“>”、“<”或“=”)。
②硫化锌的晶胞中(结构如图所示),硫离子的配位数是 。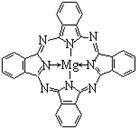
③二氧化硒分子的空间构型为 。
④砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
(12分)U、V、X、Y、Z五种短周期元素,原子序数依次增大。U、V两元素最高正价与最低负价之和均为0;Y与U同主族;X、Z分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(用实际元素符号表示)________________;
(2)由这五种元素中的几种组成的化合物A、B、C、D有如下转化关系:
其中C是溶于水显酸性的气体;D是淡黄色固体。写出C与D反应的化学方程式:___________________;
①如果B为两性不溶物,则A的化学式为_________,A转化为B的离子方程式为:__ __________;
②如果B由四种元素组成且溶液显碱性,则B含有的化学键类型是_______,A所属物质类别为_ ___________(填选项序号)。a.酸 b.碱 c.盐 d.氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素。A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍; D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6。
请回答下列问题:
(1)B、C、D、E、F五种元素原子半径由大到小的顺序是________。
(2)A和C按原子个数比1:l形成4原子分子Y.Y的结构式是________。
(3)分子X的电子式是_____________;D可以在液态X中发生类似于与A2C的反应,
写出反应的化学方程式_________________________________ 。
(4)实验证明,熔融的EF3不导电,其原因是__________________________。
(5)E的单质可溶于A、C、D形成的化合物Z的水溶液中。拉曼光谱证实此反应生成的阴离子主要以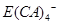 的形式存在,写出E溶于Z溶液的离子方程式:_________________________________________.
的形式存在,写出E溶于Z溶液的离子方程式:_________________________________________.
(6)工业品Z的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。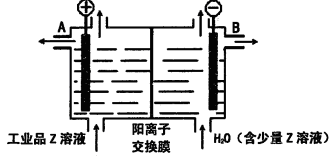
①该电解槽的阳极反应式是____________________。
②通电开始后,阴极附近溶液pH_________________(“增大”、“减小”或”不变”)。
③除去杂质后的Z溶液从液体出口___________________(填写“A”或“B”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表给出了五种元素的相关信息,其中w、X、Y、Z为短周期元素,原子序数依次递增。
| 元素 | 相关信息 |
| W | 单质为密度最小的气体 |
| X | 元素最高正价与最低负价之和为0 |
| Y | 工业上通过分离液态空气获得其单质,该单质的某种同素异形体是保护地球地表环境的重要屏障 |
| Z | 存在质量数为23,中子数为12的核素 |
| T | 金属单质为红色,导电性好,是人体不可缺少的徽量元素,焰色反应时火焰为绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硼元素B在化学中有很重要的地位。硼的化合物在农业、医院、玻璃等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子分布式 ,从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为 。
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料,同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是 。
(3)在BF3分子中中心原子的杂化轨道类型是 ,SiF4微粒的空间构型是 。
(4)科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图23是该晶体微观窨中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据图示确定硼化镁的化学式为 。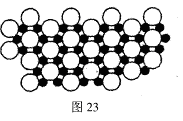
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分。请回答下列问题:
根据元素在周期表中的相对位置可知①~⑩分别是H、C、N、O、Mg、Al、Cl、Ca、Mn、Fe。
(1)上述元素中,属于s区的是____________(填元素符号)。
(2)写出元素④的基态原子的价电子排布图____________________。
(3)元素第一电离能为⑨________⑩ (填“大于”或“小于”)。
(4)元素③气态氢化物的VSEPR模型为________;该分子为________分子(填“极性”或“非极性”)。向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为_____________________________。
(5)⑥单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知⑥的原子半径为dcm,NA代表阿伏加德罗常数,元素⑥的相对原子质量为M,请回答:晶胞中⑥原子的配位数为 ,该晶体的密度为 (用字母表示)
(6)实验证明:⑤和⑧的氧化物、KCl、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示),已知3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)砷的基态原子的电子排布式为 。
(2)目前市售的发光二极管,其材质以砷化镓(GaAs)为主。Ga和As相比,电负性较大的是 ,GaAs中Ga的化合价为 。
(3)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为 ;
AsH3的沸点高于PH3,其主要原因为 。
(4)Na3AsO4可作杀虫剂。AsO43-的立体构型为 ,与其互为等电子体的分子的化学式为 (任写一种)。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因 。
(6)磷与砷同主族,磷的一种单质白磷(P4)属于分子晶体,其晶胞如图。已知最近的两个白磷分子间距离为 a pm,阿伏加德罗常数的值为NA,则该晶体的密度为______g/cm3(只要求列算式,不必计算)。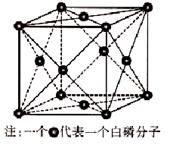
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有四种短周期元素X、Y、Z、W,其中:
① X、W原子的电子层数与最外层电子数之比分别为3:1和1:3
② Y原子是元素周期表中原子半径最小的
③ Z是形成化合物种类最多的元素
回答下列问题:
(1)X元素在周期表中的位置是 。
(2)上述四种元素中所能组成的含有非极性共价键的化合物的分子式 (填其中一种即可)。
(3)化合物X2W2的电子式是 。
(4)向含1 mol Na2SiO3的溶液中缓慢通入2 mol的ZO2,反应的离子方程式是 。
(5)由Y、Z、W元素中的两种或三种可以组成多种分子,其中含有10个电子的分子是_________(填化学式)。
(6)向25.00 mL的Y2Z2W4溶液中加入5.00 mL 0.50 mol/L酸性KMnO4溶液恰好完全反应,得到ZO2和Mn2+,则此种Y2Z2W4溶液的物质的量浓度是 mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分)A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大。A、D同主族,可形成离子化合物X;B的氢化物与F的氢化物可反应生成离子化合物Y, 且B的单质是空气中含量最高的物质;C原子的最外层电子是次外层电子数的3倍;D、E、F 3种原子最外层共有11个电子, 且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水。
(1)B元素的名称是________,B单质的结构式为_____________。
(2)用电子式表示化合物X的形成过程__________________________________。
(3)化合物Y的电子式为_____________,A2C2的电子式为_____________。
(4)D、E最高价氧化物的水化物之间反应的离子方程式为 ___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com