
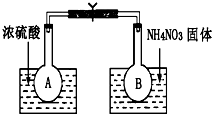
 已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:分析 Ⅰ.(1)浓硫酸稀释时放出热量,导致溶液的温度升高,硝酸铵溶解时吸收热量,导致溶液的温度降低,升高温度平衡向吸热方向移动,降低温度,平衡向放热方向移动;
(2)根据气体颜色的变化确定移动方向;
Ⅱ.(1)减小体积,二氧化氮的浓度增大,则气体颜色加深,同时增大气体压强,根据勒夏特列原理分析解答;
(2)体积变大,二氧化氮的浓度降低,颜色变浅;体积变大,压强减小,平衡向着气体体积增大的方向移动,颜色变深;根据平衡移动方向判断二氧化氮的转化率的变化.
解答 解:Ⅰ.(1)浓硫酸稀释时放出热量,导致溶液的温度升高,硝酸铵溶解时吸收热量,导致溶液的温度降低,反应2NO2(g)?N2O4(g)是放热反应,A烧杯中,升高温度,平衡向逆反应方向移动,二氧化氮气体浓度增大,气体颜色加深,降低温度,平衡向正反应方向移动,二氧化氮浓度降低,所以气体颜色变浅,
故答案为:加深; 变浅;
(2)由以上分析知,降低温度,平衡向正反应方向移动;
故答案为:正;
Ⅱ.(1)①气体体积由10cm3迅速推至5cm3处,气体体积减小,气体的体积减小时,NO2浓度增大,则气体颜色加深;
故答案为:气体的体积减小,NO2浓度增大,气体的颜色加深;
②气体体积减小,则气体压强增大,平衡向正反应方向移动,二氧化氮浓度降低,所以气体颜色变浅,
故答案为:正;
(2)体积变大,二氧化氮的浓度降低,颜色变浅;体积变大,压强减小,平衡向着气体体积增大的方向移动,颜色变深;化学平衡向着气体体积增大的方向移动,即向着生成NO2的方向移动,则NO2转化率降低;
故答案为:先变浅后变深; 减小.
点评 本题考查了温度、压强对化学平衡的影响,难度不大,根据勒夏特里原理来分析解答即可.


 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | 大于32.8% | B. | 小于32.8% | C. | 等于32.8% | D. | 约等于32.8% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2 | |
| C. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2 | |
| D. | 2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器体积不变,充入与反应体系不反应的N2,反应速率不变;压强不变,充入N2,反应速率减小 | |
| B. | 升高温度时,正反应速率增大,逆反应速率也一定增大 | |
| C. | 恒温恒容下,若X、Y起始物质的量之比为2:1,则X、Y的转化率始终相等 | |
| D. | 恒温恒压下,该反应达到平衡后若只增加Z的量,重新达到平衡,各物质的物质的量之比可能不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 50g | 20g | 20g | 10g | 5g |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K越大,达到平衡时,反应进行的程度越大 | |
| B. | K越小,达到平衡时,反应物的转化率越大 | |
| C. | K随反应物浓度的改变而改变 | |
| D. | K随温度和压强的改变而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0g | B. | 2.0g | C. | 2.5g | D. | 3.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .①②③ | B. | .②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com