
| A. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | B. | IBr+H2O═HIO+HBr | ||
| C. | 2Na2O2+4HCl═4NaCl+O2+2H2O | D. | NaH+H2O═NaOH+H2 |
分析 氧化还原反应的实质为电子的转移,特征为化合价升降,则反应中存在化合价变化的反应为氧化还原反应,没有化合价变化的反应为非氧化还原反应,据此进行解答.
解答 解:A.2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑为分解反应,反应中Mn、O元素化合价发生变化,属于氧化还原反应,故A不选;
B.反应IBr+H2O═HIO+HBr中不存在化合价变化,不属于氧化还原反应,故B选;
C.2Na2O2+4HCl═4NaCl+O2+2H2O中存在O元素化合价变化,属于氧化还原反应,故C不选;
D.NaH+H2O═NaOH+H2中存在H元素的化合价变化,属于氧化还原反应,故D不选;
故选B.
点评 本题考查了氧化还原反应的判断,题目难度不大,明确氧化还原反应的实质、特征为解答关键,注意掌握常见反应类型与氧化还原反应的关系,试题有利于提高学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 无色一氧化氮气体与空气接触变为红棕色 | |
| B. | 湿润的淀粉碘化钾试纸遇氯气变蓝色 | |
| C. | 向硫酸铜溶液中滴加氢氧化钠溶液,出现白色沉淀 | |
| D. | 将足量二氧化硫气体通入品红溶液,红色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 判断如图装置的名称:B池为电解池(填“原电池”或“电解池”)当C2极析出224mL气体(标准状况)时:锌的质量减少(填“增加”或“减少”).
判断如图装置的名称:B池为电解池(填“原电池”或“电解池”)当C2极析出224mL气体(标准状况)时:锌的质量减少(填“增加”或“减少”).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
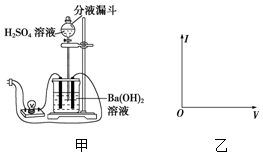 使用中学常用的实验器材,设计一个实验观察Ba(OH)2与H2SO4在溶液中的反应导电性的变化,并回答问题:
使用中学常用的实验器材,设计一个实验观察Ba(OH)2与H2SO4在溶液中的反应导电性的变化,并回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
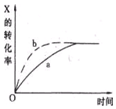 下图曲线a表示放热反应X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
下图曲线a表示放热反应X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 减压 | B. | 加大X的投入量 | C. | 升高温度 | D. | 减小体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含有等物质的量的Ba(OH)2、KOH的混合溶液中通入CO2,与CO2反应的物质依次是:KOH、Ba(OH)2、BaCO3 | |
| B. | 向含有等物质的量的Fe2+、Ag+、Cu2+的混合溶液中加入Zn,与Zn反应的离子依次是:Ag+、Cu2+、Fe2+ | |
| C. | 向含有等物质的量的AlO2-、OH-、CO32-的混合溶液中滴加盐酸,与盐酸反应的物质依次是:AlO2-、Al(OH)3、OH-、CO32- | |
| D. | 在含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气,与氯气反应的离子依次是:I-、Br-、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (一)(1)化学式为C6Hm的烷烃,m值等于14;请写出HCl的电子式
(一)(1)化学式为C6Hm的烷烃,m值等于14;请写出HCl的电子式 .
.| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡.请回答下列问题:
电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡.请回答下列问题:| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 过氧化钠投入到水中:2Na2O2+2H2O=4Na++4OH-+O2↑ | |
| B. | 氯化铵溶液与浓NaOH 溶液加热:NH4++OH-=NH3•H2O | |
| C. | 氯化铝溶液中滴入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3 NH4+ | |
| D. | 实验室制取氯气:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2Cl-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com