
| | 原子或分子相关信息 | 单质及其化合物相关信息 |
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
| Z | Z原子的最外层电子数是次外层电子数的1/2 | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
 6H++Al2O3=2Al3++3H2O
6H++Al2O3=2Al3++3H2O

科目:高中化学 来源:不详 题型:填空题
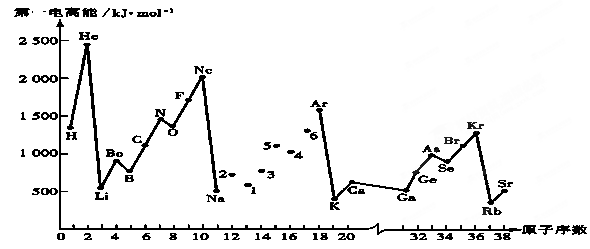
| A.3.5 | B.1.8 | C.2.5 | D.4.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.作调味剂 | B.用于食物防腐 | C.用于氯碱工业 | D.用于医疗 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 |
| D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.由金属W制备的高效电池可用 溶液作电解质 溶液作电解质 |
| B.元素Y、Z的最高价氧化物对应水化物之间可以发生反应 |
| C.元素X、Z形成的化合物为离子化合物 |
D.四种元素原子半径由大到小的顺序为: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.还原性:X的氢化物>Y的氢化物>Z的氢化物 |
| B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 |
| C.YX2、M2Y都含有极性共价键 |
| D.Z元素的最高价氧化物的水化物的化学式为HZO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素周期表中查得的相对原子质量为同位素的相对原子质量 |
| B.化学键的变化一定会引起化学反应的变化 |
| C.只含有共价键的物质一定是共价化合物 |
| D.全部由极性键构成的分子不一定是极性分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com