
分析 (1)碳酸氢钠的化学式是NaHCO3,俗称小苏打,溶液中碳酸氢根水解程度大于其电离程度,溶液呈碱性;
(2)碳酸氢钠具有弱碱性,与HCl反应生成氯化钠、水和二氧化碳,可以治疗胃酸过多;根据Na2CO3和NaHCO3分别与HCl反应的化学方程式即可得出产生CO2的物质的量之比;
(3)碳酸氢钠加热分解生成碳酸钠,可以用加热的方法除去碳酸钠固体中碳酸氢钠.
解答 解:(1)碳酸氢钠的化学式是NaHCO3,俗称小苏打,溶液中碳酸氢根水解程度大于其电离程度,溶液呈碱性,
故答案为:NaHCO3;小苏打;碱;
(2)碳酸氢钠具有弱碱性,与HCl反应生成氯化钠、水和二氧化碳,反应离子方程式为HCO3-+H+=H2O+CO2↑,故可以治疗胃酸过多;
NaHCO3与HCl反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑;Na2CO3与HCl反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;由以上两个化学方程式可以看出,等物质的量的Na2CO3和NaHCO3分别与HCl反应,产生CO2的物质的量之比为1:1,
故答案为:NaHCO3+HCl=H2O+CO2↑+NaCl;=;
(3)碳酸氢钠加热分解生成碳酸钠,可用加热的方法来除去碳酸氢钠,反应方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3 +CO2↑+H2O,
故答案为:加热;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3 +CO2↑+H2O.
点评 本题主要考查了Na2CO3和NaHCO3的性质,试题内容简单,只要掌握基础知识就可完成.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题
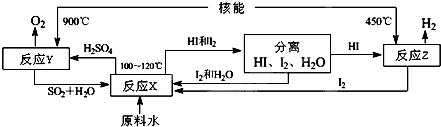
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
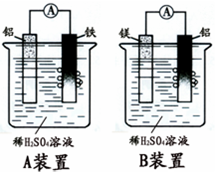 有甲.乙两位学生分别利用如图A,B装置的原电池反应检测金属的活动性顺序,
有甲.乙两位学生分别利用如图A,B装置的原电池反应检测金属的活动性顺序,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
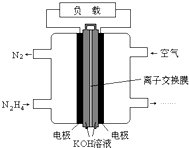 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述不正确的是( )
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述不正确的是( )| A. | 电流从右侧电极经过负载后流向左侧电极 | |
| B. | 负极发生的电极反应式为N2H4+4OH--4e-=N2+4H2O | |
| C. | 该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 | |
| D. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NaCl | CH3COONH4 | NaClO | NaHCO3 | Na2CO3 |
| pH | 7.0 | 7.0 | 10.3 | 8.3 | 11.6 |
| A. | 酸性的相对强弱:HClO>HCO3- | |
| B. | 由水电离产生的c(H+):①=② | |
| C. | 溶液③④中酸根离子浓度:c(ClO-)>c(HCO3-) | |
| D. | 在④⑤溶液等体积混合后的溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3易溶于水形成胶体 | |
| B. | CuSO4溶液可观察到丁达尔现象 | |
| C. | Fe(OH)3胶体可观察到丁达尔现象 | |
| D. | 胶体分散系中所有粒子的直径都在1~1000 nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 21.2g | B. | 21.6g | C. | 22.0g | D. | 22.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 H2SO4 溶液是指含有硫酸的质量为9.8 g | |
| B. | 从1L0.5mol•L-1 H2SO4溶液中取出100mL,则取出溶液的物质的量浓度为0.5mol•L-1 | |
| C. | 取0.1mol•L-1H2SO4溶液10mL,加100mL水稀释后,H2SO4的物质的量浓度为0.01mol•L-1 | |
| D. | 150mL 1mol•L-1的NaCl溶液与75mL1mol•L-1的AlCl3溶液Cl-浓度相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com