
 | 现象 1A试管中黑色沉淀逐渐溶解 2A试管内上方出现浅红棕色气体 3B试管中出现白色沉淀 |
分析 (1)铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水;
(2)对比实验分析反应现象,判断黑色物质成分;
(3)①红棕色气体为二氧化氮,说明稀硝酸被还原生成一氧化氮,黑色固体具有还原性;
②一氧化氮与空气中的氧气反应生成红棕色的二氧化碳气体,据此写出反应的化学方程式;
③根据反应现象③可知黑色固体与稀硝酸反应生成了二氧化硫,证明黑色固体中含有硫元素;二氧化氮、二氧化硫的混合气体能够与氯化钡反应生成硫酸钡沉淀,据此写出反应的离子方程式;
④还需要确定黑色固体中含有铜离子;
(4)浓硫酸具有强氧化性,能够将硫化亚铜中硫氧化成硫酸铜、二氧化硫和水,据此写出反应的化学方程式.
解答 解:(1)铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)①将CuO放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色物质放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,说明黑色沉淀中不含CuO,实验①的目的是做对比实验观察反应现象,
故答案为:做对比实验;黑色沉淀中不含CuO;
(3)①A试管内上方出现红棕色气体,说明反应中有一氧化氮生成,证明了黑色固体具有还原性,在反应中被氧化,
故答案为:还原;
②红棕色气体为二氧化氮,反应的化学方程式为:2NO+O2═2NO2,
故答案为:2NO+O2═2NO2;
③根据反应现象③B试管中出现白色沉淀可知,白色沉淀为硫酸钡,说明黑色固体中含有硫元素,发生反应的离子方程式为:NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+,
故答案为:B试管中出现白色沉淀;
(4)浓硫酸具有强氧化性,硫化亚铜与浓硫酸反应,已知1molCu2S与稀硝酸反应转移8mole-,反应的化学方程式为:3Cu2S+2OHNO3$\frac{\underline{\;\;△\;\;}}{\;}$6Cu(NO3)2+3SO2↑+8NO↑+10H2O,
故答案为:3Cu2S+20HNO3$\frac{\underline{\;\;△\;\;}}{\;}$6Cu(NO3)2+3SO2↑+8NO↑+10H2O.
点评 本题考查了浓硫酸的化学性质、性质实验方案的设计,题目难度中等,试题涉及的题量稍大,知识点较大,理解题中信息是解题关键,如根据铜离子检验方法解答(4)④;试题培养了学生的分析、理解能力.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题

| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 | HVO3 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 | 难溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中氮气作还原剂 | |
| B. | 氮氧化铝中氮元素的化合价是-3 | |
| C. | 氮氧化铝晶体中的作用力是范德华力 | |
| D. | 根据氮氧化铝晶体的硬度可推断其晶体类型可能与石英相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
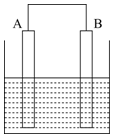
| A. | 导线中有电子流动,电流方向为A流向B | |
| B. | 溶液中的O2在电极B得电子,电极B附近碱性增强 | |
| C. | 电极A上的电极反应式为Fe-2e-=Fe2+ | |
| D. | 溶液中的Na+向电极B附近移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将化学能转变为电能的装置 | |
| B. | 构成原电池的正极和负极必须是两种不同的金属 | |
| C. | 原电池放电时,电流的方向是从正极到负极 | |
| D. | 在原电池中,电子流出的一极是负极,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 共价键 | C-H | H-H | C≡C |
| 键能/kJ•mol-1 | 413.4 | 436 | 812 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①②中都存在:△S>0  (1)+H2(g)→ (1)+H2(g)→ (1)△H>0① (1)△H>0① | |
| B. | 反应②高温时,可自发进行 | |
| C. | 在通常情况下,①②都能自发进行 (1)+H2(g)→ (1)+H2(g)→ (1)△H<0② (1)△H<0② | |
| D. | 反应①一定不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com