
【题目】锰锌铁氧体是应用广泛的高性能磁性材料。现以akg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%)制备锰锌铁氧体,主要流程如下:
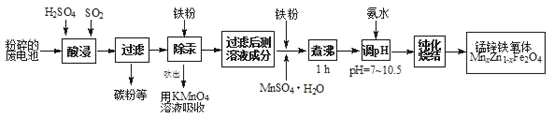
(1)酸浸废电池时,被溶解生成Zn2+的物质有______,SO2的作用是_____(填字母编号)。
A.漂白剂 | B.沉淀剂 | C.氧化剂 | D.还原剂 |
(2)除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。如图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围反应的主要产物。
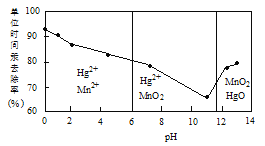
①pH<6时反应的离子方程式为___________。
②汞的去除速率随pH变化的规律是_________。
(3)锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)=2MnO2(s) H=-272.0 kJ/mol
MnCO3(s)=MnO(s)+CO2(g) H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是_______________。
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为____________。若制得这种锰锌铁氧体的质量为100 kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4·H2O)_________kg。(只列出计算式)
【答案】Zn、Zn(OH)2 D 2MnO4-+5Hg+16H+=2Mn2++5Hg2++8H2O 随pH增大,汞的去除速率先减小后增大 2MnCO3(s)+O2(g)=2MnO2(s)+2CO2(g) H=-38.8 kJ/mol MnO·4ZnO·5Fe2O3 169×(![]() -
-![]() -
-![]() )
)
【解析】
废旧碱性锌锰电池中含有Zn、Zn(OH)2、碳粉以及MnO2和MnOOH等,加入稀硫酸、通入二氧化硫,Zn、Zn(OH)2和硫酸反应生成Zn2+,MnO2和MnOOH在酸性条件下被二氧化硫还原为Mn2+,过滤除去碳粉,滤液中加入铁粉、MnSO4·H2O,煮沸1h,再加氨水调节PH至7~10.5,纯化烧结得到锰锌铁氧体。
(1)锌锰电池中含有锌的物质有Zn、Zn(OH)2,可以与酸反应生成锌离子;SO2在此作了还原剂。
(2)①据图得pH<6时主要以Mn2+和Hg2+存在,故反应:2MnO4-+5Hg+16H+=2Mn2++5Hg2++8H2O;②据图像得随pH增大,汞的去除速率先减小后增大。
(3)已知25℃,101 kPa时:①2MnO(s)+O2(g)=2MnO2(s) H1=-272.0 kJ/mol②MnCO3(s)=MnO(s)+CO2(g) H2=+116.6 kJ/mol碳酸锰在空气中煅烧反应生成MnO2的化学方程式是2MnCO3(s)+O2(g)=2MnO2(s)+2CO2(g) H3,据盖斯定律H3=H1+2H2=-38.8 kJ/mol。
(4)x=0.2时,锰锌铁氧体的化学式为Mn0.2Zn0.8Fe2O4,化为整数关系为Mn1Zn4Fe10O20,写成氧化物形式:MnO·4ZnO·5Fe2O3;据题意aKg电池中Mn的物质的量=![]() +
+![]() ,100 kg锰锌铁氧体中Mn的物质的量为100/1195=
,100 kg锰锌铁氧体中Mn的物质的量为100/1195=![]() , 需补充硫酸锰晶体(MnSO4·H2O)物质的量=
, 需补充硫酸锰晶体(MnSO4·H2O)物质的量=![]() -(
-(![]() +
+![]() ),质量=169×(
),质量=169×(![]() -
-![]() -
-![]() ) kg。
) kg。


科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O。已知两极室中电解质足量,下列说法正确的是( )

A.正极的电极反应式为2H++2e-═H2↑
B.电池工作时,H+通过质子交换膜向负极移动
C.电池工作时,正、负极分别放出H2和NH3
D.工作一段时间后,若左右两极室质量差为1.9g,则电路中转移0.6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于反应mA(g)+n(B)![]() cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,
cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,
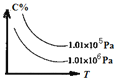
下列该反应的![]() 、
、![]() 判断正确的是
判断正确的是
A.![]() >0,
>0,![]() <0B.
<0B.![]() <0,
<0,![]() >0
>0
C.![]() >0,
>0,![]() >0D.
>0D.![]() <0,
<0,![]() <0
<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z的原子序数依次增大,R和Y位于同主族,R-和Y+的简单离子相差8个电子。甲、乙化合物均含上述四种元素;常温下,0.01molL-1甲溶液的pH=2,0.01molL-1乙溶液的pH=a(2<a<7)。向乙溶液中滴加甲溶液,产生气体的物质的量与甲的物质的量关系如图所示(假设气体全部排出)。下列说法不正确的是( )
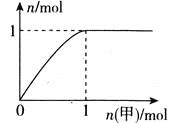
A.简单的离子半径:Z>X>Y
B.简单气态氢化物的热稳定性:X>Z
C.甲、乙中均含有离子键和共价键
D.常温下,甲、乙溶液中由水电离出的H+和OH-之间存在:c(H+)水c(OH-)水=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种烃分子的结构如图所示,下列有关说法错误的是( )
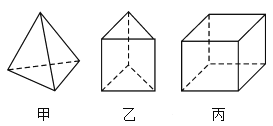
A.1 mol甲分子内含有10 mol共价键
B.由乙分子构成的物质不能发生氧化反应
C.丙分子的二氯取代产物只有三种
D.三者不互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1mol·L-1NaA溶液中通人HC1气体,溶液的pH随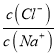 变化的关系如图所示。忽略溶液体积变化,下列有关说法不正确的是
变化的关系如图所示。忽略溶液体积变化,下列有关说法不正确的是
A.水的电离程度:b>a
B.a点溶液中:c(Na+)+c(H+)=c(Cl-)+c(A-)+c(OH-)
C.b点溶液中:c(A-)+2c(H+)=c(HA)+2c(OH-)
D.Ka(HA)的数量级为l0-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法中正确的是( )
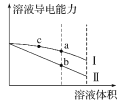
A.两溶液稀释前的浓度相同
B.a、b、c三点溶液的pH由大到小顺序为a>b>c
C.a点的Kw值比b点的Kw值大
D.a点水电离的c(H+)大于c点水电离的c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内只有一个质子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。回答下列问题:
(1)C在元素周期表中的位置为______,G的原子结构示意图为______。
(2)D与E按原子个数比1:1形成化合物甲,其电子式为______,所含化学键类型为______,向甲中滴加足量水时发生反应的化学方程式为______。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序为______(用离子符号表示)。
(4)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极,在a极通入BA4气体,b极通入D2气体,则a极是该电池的______极,正极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5.56gFeSO4·7H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,下列说法不正确的是( )
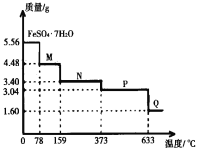
A.温度为78℃时固体物质M的化学式为FeSO4·4H2O
B.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O
FeSO4+H2O
D.温度为159℃时固体N的化学式为FeSO4·2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com