
【题目】2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2 [Sn(OH)6][B(OH)4] 2并获得了该化合物的LED器件,该研究结果有望为白光发射的设计和应用提供一个新的有效策略。
(1)基态Sn原子价层电子的空间运动状态有___种,基态氧原子的价层电子排布式不能表示为![]() ,因为这违背了____原理(规则)。
,因为这违背了____原理(规则)。
(2)[B(OH)4] -中氧原子的杂化轨道类型为____,[B(OH)4] -的空间构型为______。 [Sn(OH)6] 2-中,Sn与O之间的化学键不可能是___。
a ![]() 键 b σ键 c 配位键 d 极性键
键 b σ键 c 配位键 d 极性键
(3)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是_____(填化学式),其原因是___________。
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,则1号砷原子的坐标为____。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为__g·cm-3(列出含a、NA的计算式即可)。
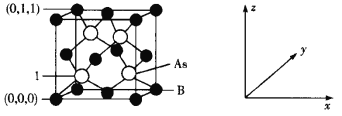
【答案】3 洪特 sp3 正四面体 a BaO 离子半径越小,晶格能越大,物质的熔点越高 (![]() ,
,![]() ,
,![]() )
) 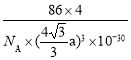
【解析】
(1)Sn元素与C元素为同主族元素,位于第五周期,所以其价层电子为5s25p2,5s能级的s轨道为一种空间运动状态,5p能级占据两个p轨道有两种空间运动状态,共有3种空间运动状态;根据洪特规则,同一能级电子要优先以自旋相同的方式分别占据不同的轨道,所以该排布式违反了洪特规则;
(2)[B(OH)4] -中每个氧原子与氢原子和B原子各形成一个σ键,还有2对孤电子对,所以价层电子对数为4,为sp3杂化;[B(OH)4] -中B原子与每个氧原子之间均形成一个σ键(其中一个为配位键),价层电子对数为4,且不含孤电子对,所以空间构型为正四面体;[Sn(OH)6] 2-中,O原子和氢原子之间为σ键,也为极性共价键,Sn原子和O原子之间有σ键和配位键,所以该物质中不含π键,所以选a;
(3)碳酸钡、碳酸镁分解得到的金属氧化物分别为BaO和MgO,镁离子核外电子层数少于钡离子,所以镁离子半径更小,形成的离子键更强,晶格能更大,熔点较高;
(4)根据晶胞结构可知1号砷原子距离坐标原点的距离为晶胞体对角线的![]() ,所以坐标为(
,所以坐标为(![]() ,
,![]() ,
,![]() );根据晶胞结构可知,距离最近的As原子和B原子即为1号砷原子距离坐标原点B原子的距离,所以晶胞体对角线的长度为4a pm,则晶胞的棱长为
);根据晶胞结构可知,距离最近的As原子和B原子即为1号砷原子距离坐标原点B原子的距离,所以晶胞体对角线的长度为4a pm,则晶胞的棱长为![]() a pm,则晶胞的体积V=
a pm,则晶胞的体积V=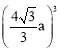 pm3=
pm3=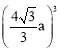 ×10-30cm3;根据均摊法该晶胞中As原子个数为4,B原子个数为
×10-30cm3;根据均摊法该晶胞中As原子个数为4,B原子个数为![]() =4,所以晶胞的质量m=
=4,所以晶胞的质量m=![]() ,所以密度为
,所以密度为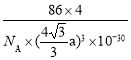 g/cm3。
g/cm3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺。
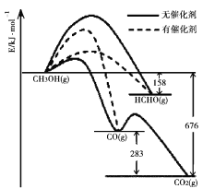
Ⅰ.(1)催化剂的选择性指在能发生多种反应的反应系统中,同一催化剂促进不同反应的程度的比较,实质上是反应系统中目的反应与副反应之间反应速度竞争的表现。如图所示为一定条件下![]() 与
与![]() 发生反应时,生成
发生反应时,生成![]() 、
、![]() 或
或![]() 的能量变化图[反应物
的能量变化图[反应物![]() 和生成物
和生成物![]() 略去]。在有催化剂作用下,
略去]。在有催化剂作用下,![]() 与
与![]() 反应主要生成____(选填“
反应主要生成____(选填“![]() 或
或![]() 或
或![]() ”)。
”)。
(2)2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家哈德·埃特尔,他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。埃特尔研究的氮气和氢气分子在固体催化剂表面发生的部分变化过程如图所示:
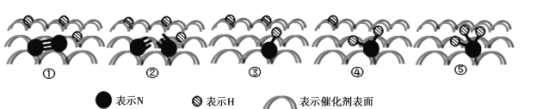
①下列说法不正确的是_________。
A.升高温度可以提高一段时间内![]() 的生产效率
的生产效率
B.图示中的②→③以及后面几个过程均是放热过程
C.此图示中存在![]() 键断裂和
键断裂和![]() 键断裂,以及
键断裂,以及![]() 键的形成过程
键的形成过程
②合成氨工业中,原料气(![]() 、
、![]() 及少量
及少量![]() 、
、![]() 的混合气)在进入合成塔前常用
的混合气)在进入合成塔前常用![]() (醋酸二氨合亚铜,
(醋酸二氨合亚铜,![]() 代表醋酸根)溶液来吸收原料气中的
代表醋酸根)溶液来吸收原料气中的![]() ,其反应是:
,其反应是:![]() ,生产中必须除去原料气中
,生产中必须除去原料气中![]() 的原因是_________;
的原因是_________;![]() 溶液吸收原料气中的
溶液吸收原料气中的![]() 的生产适宜条件应是____________。
的生产适宜条件应是____________。
Ⅱ.氮循环是指氮在自然界中的循环转化过程,是生物圈内基本的物质循环之一,存在较多蓝、绿藻类的酸性水体中存在如有图所示的氮循环,请回答相关问题。
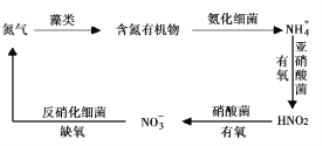
(3)![]() 硝化过程的方程式是
硝化过程的方程式是![]() ,恒温时在亚硝酸菌的作用下发生该反应,能说明体系达到平衡状态的是____(填标号)。
,恒温时在亚硝酸菌的作用下发生该反应,能说明体系达到平衡状态的是____(填标号)。
A.溶液的![]() 不再改变
不再改变
B.![]() 的消耗速率和
的消耗速率和![]() 的生成速率相等
的生成速率相等
C.溶液中![]() 、
、![]() 、
、![]() 的总物质的量保持不变
的总物质的量保持不变
实验测得在其它条件一定时,![]() 硝化反应的速率随温度变化曲线如下图A所示,温度高于35℃时反应速率迅速下降的原因可能是__________________。
硝化反应的速率随温度变化曲线如下图A所示,温度高于35℃时反应速率迅速下降的原因可能是__________________。

(4)亚硝酸盐含量过高对人和动植物都会造成直接或间接的危害,因此要对亚硝酸盐含量过高的废水进行处理。处理亚硝酸盐的方法之一是用次氯酸钠将亚硝酸盐氧化为硝酸盐,反应方程式是![]() 。在25℃和35℃下,分别向
。在25℃和35℃下,分别向![]() 初始浓度为
初始浓度为![]() 的溶液中按不同的投料比
的溶液中按不同的投料比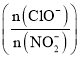 加入次氯酸钠固体(忽略溶液体积的变化),平衡时
加入次氯酸钠固体(忽略溶液体积的变化),平衡时![]() 的去除率和温度、投料比的关系如上图B所示,a、b、c、d四点
的去除率和温度、投料比的关系如上图B所示,a、b、c、d四点![]() 的转化率由小到大的顺序是______,35℃时该反应的平衡常数
的转化率由小到大的顺序是______,35℃时该反应的平衡常数![]() ______(保留三位有效数字)。
______(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
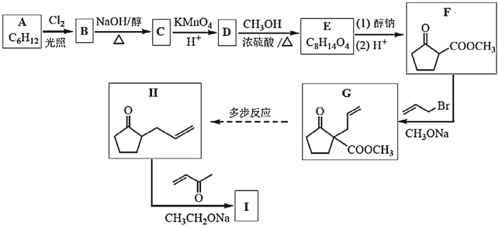
【题目】化合物I是合成六元环甾类化合物的一种中间体。合成I的路线如图:
已知:①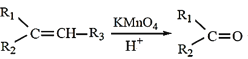 +R3COOH(—R1、—R2、—R3均为烃基)
+R3COOH(—R1、—R2、—R3均为烃基)
②![]()
③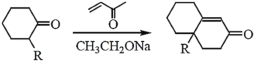
回答下列问题:
(1)苯与H2在一定条件下加成可得A,A的结构简式是___;
(2)B为一氯代物,B→C的化学方程式是___;
(3)D中的官能团名称是___;
(4)D→E的化学方程式是___;
(5)下列说法正确的是__;
a.物质F的核磁共振氢谱有2组吸收峰;
b.F→G的反应类型为加成
c.1mol物质G与氢气加成最多消耗氢气的物质的量为2mol;
d.物质H存在顺反异构体;
(6)物质I的结构简式是___;
(7)请写出以B为原料(其他试剂任选)合成![]() 的路线______。
的路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36g碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积,且C(s)+
体积,且C(s)+![]() O2(g)=CO(g) ΔH=-110.5 kJ/mol;CO(g)+
O2(g)=CO(g) ΔH=-110.5 kJ/mol;CO(g)+![]() O2(g)=CO2(g) ΔH=-283kJ/mol,与这些碳完全燃烧相比,损失的热量是
O2(g)=CO2(g) ΔH=-283kJ/mol,与这些碳完全燃烧相比,损失的热量是
A.172.5kJB.1149kJ
C.283kJD.566kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中充入1mol X和1mol Y进行反应:2X(g)+Y(g)![]() Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
A.X的平衡转化率为40%
B.若将容器体积变为20L,则Z的平衡浓度小于原来的![]()
C.若增大压强,则Y的平衡转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如图所示:
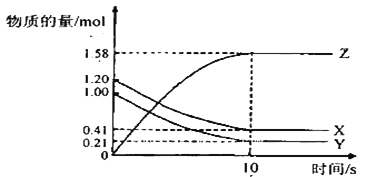
下列描述正确的是( )
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)-1
B. 反应开始到l0s,X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车排放的尾气是大气污染气体之一。如何减少污染气体的排放是科学家研究的热门课题。请回答下列问题:
(1)已知:CO的燃烧热为283.0kJ·mol-1,N2(g)+2O2(g)![]() 2NO2(g) ΔH= +64kJ·mol-1,则NO2(g)+2CO(g)=
2NO2(g) ΔH= +64kJ·mol-1,则NO2(g)+2CO(g)=![]() N2(g)+2CO2(g) ΔH=____kJ·mol-1,若该反应中有14g还原剂发生反应,则转移电子___mol。
N2(g)+2CO2(g) ΔH=____kJ·mol-1,若该反应中有14g还原剂发生反应,则转移电子___mol。
(2)使汽车排放的CO和NO在一定条件下发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),可有效地减少空气污染。若在一定温度下,将6mol NO、8mol CO充入10L固定容积的容器中发生上述反应,反应过程中各物质的浓度变化如图1所示。
N2(g)+2CO2(g),可有效地减少空气污染。若在一定温度下,将6mol NO、8mol CO充入10L固定容积的容器中发生上述反应,反应过程中各物质的浓度变化如图1所示。
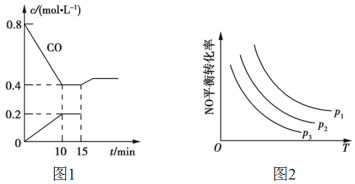
①该反应的化学平衡常数K=___。NO的平衡转化率=____。
②15min时,若改变反应条件,导致CO浓度发生如图1所示的变化,则改变的条件可能是___(填标号)。
a.缩小容器体积 b.增加CO2的量 c.体积不变通入少量氩气 d.加入催化剂
③当NO与CO的起始浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图2所示,则下列说法正确的是____ (填标号)。
A.该反应ΔH<0
B.p1<p2<p3
C.升高温度正反应速率减小,逆反应速率增大
D.温度不变,增大压强,平衡常数增大
④以下说法中能判断反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)达到平衡的是____(填标号)。
N2(g)+2CO2(g)达到平衡的是____(填标号)。
A.反应物和生成物的物质的量相等
B.单位时间内生成1mol NO同时生成1mol CO2
C.混合气体压强不再发生变化
D.NO的浓度不再变化
⑤向反应容器中再分别充入下列气体,能使NO转化率增大的是____(填标号)。
A.O2 B.N2 C.CO D.NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解![]() 溶液,原理如图所示。下列说法正确的是( )
溶液,原理如图所示。下列说法正确的是( )
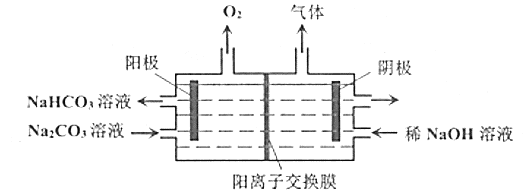
A.随着电解的进行,阴极区溶液的pH变小
B.![]() 从阴极穿过交换膜向阳极移动
从阴极穿过交换膜向阳极移动
C.若利用可逆反应原电池做此电解装置的电源,当原电池中发生的反应达平衡时,该电解装置不会停止工作
D.阳极电极反应式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌空气燃料电池广泛用于铁路、航海灯标以及助听器中,其装置示意图如图所示。下列说法错误的是( )
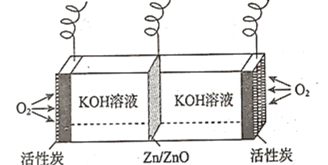
A.放电时,负极的电极反应式为![]()
B.放电时,![]() 向活性炭电极方向移动
向活性炭电极方向移动
C.充电时,![]() 电极上的电势比活性炭电极上的高
电极上的电势比活性炭电极上的高
D.充电时阴极质量减小![]() ,理论上阳极生成
,理论上阳极生成![]() 气体
气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com