
| A. | 阴、阳离子之间通过相互吸引作用形成的化学键叫离子键 | |
| B. | 根据电离方程式HCl=H++Cl-,可判断HC1分子里存在离子键 | |
| C. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| D. | 离子化合物一定由金属元素和非金属元素组成 |
分析 A.离子键为静电作用力;
B.HCl中只含H-Cl共价键;
C.化学键断裂吸收能量,生成化学键释放能量;
D.铵盐为离子化合物.
解答 解:A.阴、阳离子之间通过静电(含引力和斥力)作用形成的化学键叫离子键,故A错误;
B.HCl中只含H-Cl共价键,但溶于水发生电离为HCl=H++Cl-,故B错误;
C.化学键断裂吸收能量,生成化学键释放能量,化学反应的实质为化学键的断裂和形成,则化学键的断裂和形成是化学反应能量变化的主要原因,故C正确;
D.铵盐为离子化合物,但不含金属元素,氯化铝含金属元素为共价化合物,故D错误;
故选C.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断是为解答的关键,并注意利用实例来分析解答,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 下表是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
下表是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙炔分子中不存在非极性键 | |
| B. | 丙炔分子中3个碳原子都是sp3杂化 | |
| C. | 丙炔分子中所有的原子都在同一直线上 | |
| D. | 丙炔分子中σ键与π键的个数比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大.X的核外电子总数与其周期数相同,Y基态原子的p电子数比s电子数少1个,Z基态原子的价电子层中有2个未成对电子,T与Z同主族,W基态原子的M层全充满,N层只有一个电子.回答下列问题:
周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大.X的核外电子总数与其周期数相同,Y基态原子的p电子数比s电子数少1个,Z基态原子的价电子层中有2个未成对电子,T与Z同主族,W基态原子的M层全充满,N层只有一个电子.回答下列问题: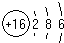 ,W基态原子的电子排布式为[Ar]3d104s1.
,W基态原子的电子排布式为[Ar]3d104s1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ba2+、NO3-、Cl- | B. | Na+、NH4+、SO42-、HCO3- | ||
| C. | Ca2+、K+、SO32-、NO3- | D. | Na+、K+、Cu2+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 中国研制成功的全球唯一的治疗疟疾特效药--青蒿素,是数亿外国人眼中的“中国神药”,结构如图所示.目前售价每克225美元,世界年产量15吨,是需求量的十分之一,供不应求.下列关于青蒿素的说法正确的是( )
中国研制成功的全球唯一的治疗疟疾特效药--青蒿素,是数亿外国人眼中的“中国神药”,结构如图所示.目前售价每克225美元,世界年产量15吨,是需求量的十分之一,供不应求.下列关于青蒿素的说法正确的是( )| A. | 是一种烃 | B. | 属于高分子化合物 | ||
| C. | 属于芳香族化合物 | D. | 分子式是C15H22O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从氟到碘,其氢化物的稳定性逐渐减弱 | |
| B. | 氧与硫为同主族元素,氧比硫的原子半径小,氧比硫的非金属性强 | |
| C. | 第三周期从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 | |
| D. | 因为铝原子比钠原子失去电子数目多,所以铝比钠的还原性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ca2+、HCO3-、Cl- | B. | Na+、K+、Cl-、SO42- | ||
| C. | NH4+、K+、Cl-、SO32- | D. | K+、Cl-、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com