
| ||
| A、SiO2是还原剂 |
| B、氧化剂与还原剂的质量比为1:2 |
| C、生成1molSi此反应中电子转移4mol |
| D、CO是还原产物 |


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
| A、原子序数大小:X>Y |
| B、Xm+和Yn-离子半径大小:Yn-<Xm+ |
| C、在周期表中X、Y在不同周期 |
| D、在周期表中X、Y的族序数之差为:8-(m+n) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解精炼铜时,若转移了NA个电子,则阴极析出32g铜 |
| B、标准状态下,33.6L氟化氢中含有1.5NA个氟化氢分子 |
| C、0.1mol/L的Al2(SO4)3溶液中,Al3+的数目小于0.2NA |
| D、1mol FeCl3跟水反应,完全转化为氢氧化铁胶体后,其中胶体粒子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、在稀氨水中通入过量CO2:NH3?H2O+CO2=N
| ||||
| B、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | ||||
C、向Ba(OH)2溶液中加入少量的NaHSO3溶液2HS
| ||||
| D、氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-=CaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
| A、上述反应中的氧化剂是Cl2 |
| B、该反应过程中只有氮元素被氧化 |
| C、还原性:CN->Cl- |
| D、当有1 molCl2参加反应时,转移的电子数为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据化合物在水溶液或熔融状态下是否导电,将化合物分为电解质和非电解质 |
| B、氨气的水溶液能够导电,因此NH3是电解质 |
| C、电解质溶液的导电能力与溶液中离子浓度及离子所带电荷多少有关 |
| D、溶液与胶体的本质区别是分散质颗粒直径大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 钠 | Na2CO3 | 金刚石 | 石墨 | |
| 熔点(℃) | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:| T/K | 298 | 398 | 498 | … |
| K/(mol?L-1)2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
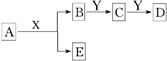 中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去).下列推断正确的是( )
中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去).下列推断正确的是( )| A、若A是CaC2,X是H2O,则Y一定是溴水 |
| B、若A是金属钠,X是H2O,则E一定能还原Fe2O3 |
| C、若Y是NaOH,C是白色沉淀,则A与X一定发生置换反应 |
| D、若Y是氧气,D是氧化物,则A与X一定发生氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com