
| A. | N2 | B. | O2 | C. | H2O | D. | CO2 |
 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1稀硫酸100mL中含有硫酸根个数为0.1NA | |
| B. | 1molC10H22分子中共价键总数为31NA | |
| C. | 7.1g氯气与足量的NaOH溶液反应,转移电子数为0.2NA | |
| D. | 9g重水中所含有的电子总数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者均属于无机物 | |
| B. | 二者均属于混合物 | |
| C. | 前者属于有机高分子化合物,后者属于无机酸铵盐 | |
| D. | 前者属于有机高分子化合物,后者属于有机酸铵盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Ag+、Cl- | B. | Ca2+、NO3-、Mg2+ | C. | Na+、CO32-、Fe2+ | D. | Cu2+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别如表和如图所示:下列有关推断正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别如表和如图所示:下列有关推断正确的是( ) | 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 10 min内甲容器中反应的平均速率v(A)=0.1 mol/(L•min) | |
| B. | T1<T2,正反应为吸热反应 | |
| C. | 平衡时保持温度不变,缩小容器体积平衡向正反应方向移动 | |
| D. | T1℃时,若起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
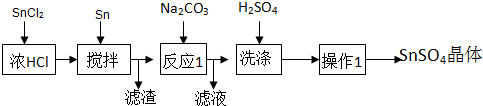
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com