
| A. | 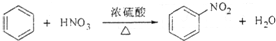 | |
| B. |  | |
| C. | CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | CH4+Cl2$\stackrel{光照}{?}$CH3Cl+HCl |
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应均为黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃.
已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应均为黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
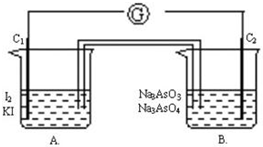 根据可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如下图所示实验装置.
根据可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如下图所示实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
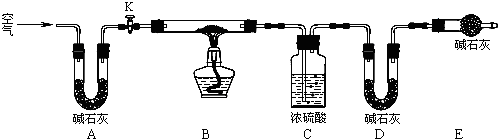
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、Cl-、NO3- | B. | K+、H+、CO32-、HCO3- | ||
| C. | Ca2+、Ba2+、Cl-、HCO3- | D. | Na+、Ba2+、HCO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 将氯化亚铁溶液和氯气反应:Fe2++Cl2═Fe3++2 Cl- | |
| D. | 将铜屑加入含Fe3+的溶液中:2Fe3++Cu═2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
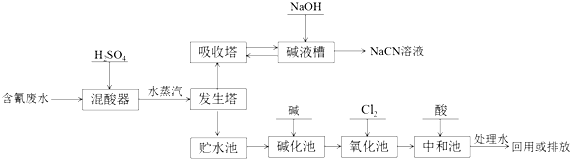
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 硼化钒(VB2)、空气电池是目前储电能力最高的电池,电池示意图如图.该电池的反应产物分别是V2O5和B的最高价氧化物.下列说法正确的是( )
硼化钒(VB2)、空气电池是目前储电能力最高的电池,电池示意图如图.该电池的反应产物分别是V2O5和B的最高价氧化物.下列说法正确的是( )| A. | 图中选择性透过膜应只允许阴离子通过 | |
| B. | 电池工作过程中a电极附近溶液pH减小 | |
| C. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| D. | 如果负载为氯碱工业装置,外电路中转移0.1mol电子,则阴极生成气体1120mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com