
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
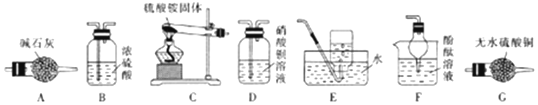
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
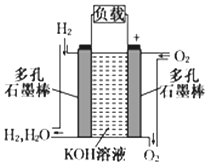 被誉为改变未来世界十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给反应体系适当加热 | B. | 向反应体系中加水稀释 | ||
| C. | 加入少量氧化铜固体 | D. | 加压 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双氧水、高锰酸钾溶液可以杀灭病毒,其消毒原理与二氧化硫漂白丝织物原理相同 | |
| B. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 石油分馏、海水晒盐、燃煤烟气的脱硫、从菜籽中提取菜籽油等过程都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该反应中反应物的总能量大于生成物的总能量 | |
| B. | 该反应中反应物的总能量小于生成物的总能量 | |
| C. | 该反应发生时,一定不需要加热 | |
| D. | 如果该反应开始后停止加热,反应一定能继续进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
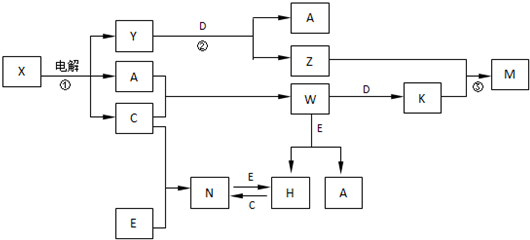
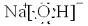 ,构成E单质的元素在周期表中位于第四周期第Ⅷ族.
,构成E单质的元素在周期表中位于第四周期第Ⅷ族.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com