
| A. | 相等 | B. | 后者是前者的11倍 | ||
| C. | 后者是前者的108 | D. | 前者是后者的108 |
分析 酸或碱抑制水电离,含有弱根离子的盐促进水电离,根据溶液的pH结合水的离子积常数计算水电离出的氢氧根离子浓度.
解答 解:氢氧化钠抑制水电离,氢氧化钠溶液中水电离出的氢氧根离子浓度等于氢离子浓度,则氢氧化钠溶液中水电离出的c(OH-)=c(H+)=10-11mol/L;氰化钠是强碱弱酸盐,促进水电离,溶液中氢氧根离子就是水电离出的氢氧根离子,所以由水电离出的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=0.001mol/L,则由水电离出的c(OH-)之比=10-11mol/L:0.001mol/L=10-8:1,故选C.
点评 本题考查了pH的简单计算,明确酸或碱、含有弱根离子的盐对水电离的影响是解本题关键,难度中等.


科目:高中化学 来源: 题型:实验题
 氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g);△H<0.
氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g);△H<0.| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| I | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
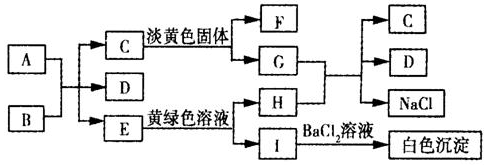
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
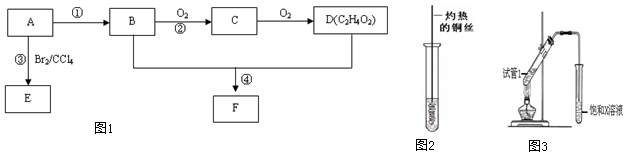
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
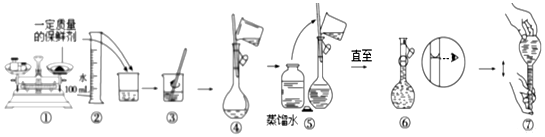
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
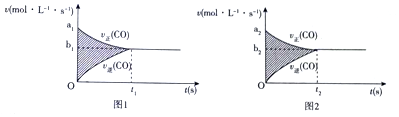
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com