
分析 (1)已知常温下,氨水中NH3•H2O的电离平衡常数:K=1.6×10-5,根据c=$\frac{1000ρw}{M}$计算浓度,结合k=$\frac{c(O{H}^{-})•c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$,计算氢氧根离子浓度,进而计算氢离子浓度和pH;
(2)若将其稀释一倍,K不变,微粒浓度变为原来的一半,据此计算.
解答 解:(1)已知常温下,氨水中NH3•H2O的电离平衡常数:K=1.6×10-5,c=$\frac{1000ρw}{M}$=0.582mol/L,k=$\frac{c(O{H}^{-})•c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$,解得x=3×10-3,PH=-lgc(H+)=-lg$\frac{Kw}{c(O{H}^{-})}$=10.53,答:该氨水的pH=10.53,
(2)若将其稀释一倍,K不变,K=$\frac{{c}^{2}(O{H}^{-})}{\frac{0.582}{2}-x}$,解出c(OH-)=4.32×10-3,解出pH=10.36,答:若将其稀释一倍,pH为10.36.
点评 本题考查学生pH的计算知识,注意公式的归纳和梳理是关键,难度不大.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 8:3 | B. | 3:8 | C. | 27:4 | D. | 4:27 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
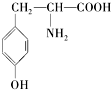 营养品和药品都是保证人类健康不可缺少的物质,其性质和制法是化学研究的主要内容.已知酪氨酸是一种生命活动不可缺少的氨基酸,它的结构简式是:
营养品和药品都是保证人类健康不可缺少的物质,其性质和制法是化学研究的主要内容.已知酪氨酸是一种生命活动不可缺少的氨基酸,它的结构简式是: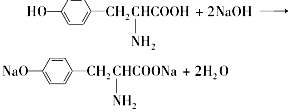 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度的NaCl和AlCl3混合液完全电解后,所得的混合液的pH值增大 | |
| B. | NaCl溶液电解一定时间后,要恢复到电解前状态,应加入适量盐酸 | |
| C. | Na2SO4溶液在电解过程中,阴极区pH值降低 | |
| D. | 电解CuSO4溶液,阳极反应式为:2H2O+O2+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
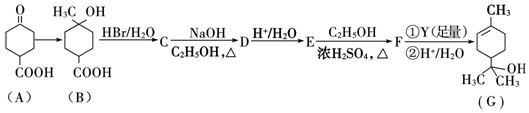
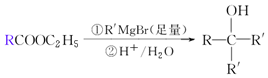
 .
. .①核磁共振氢谱有2个吸收峰 ②能发生银镜反应
.①核磁共振氢谱有2个吸收峰 ②能发生银镜反应 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| B. | 1mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数NA个 | |
| C. | 7.8gNa2O2与过量水反应转移电子数为0.1NA | |
| D. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,当有3NA个电子转移时,△H变为-46.2kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液加入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 金溶于王水生成AuCl4-离子和NO:Au+4H++4Cl-+NO3-═AuCl4-+NO↑+2H2O | |
| D. | 用NaClO溶液吸收过量的SO2:ClO-+SO2+H2O═HSO3-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com