
【题目】写出下列反应的化学方程式或离子方程式
(1)过氧化钠与二氧化碳反应的化学方程式:_______________________________。
(2)铁与水蒸气的反应的化学方程式:___________________________________。
(3)碳酸钠溶液与盐酸反应离子方程式:___________________。
(4)碳酸氢钠溶液与氢氧化钠溶液反应离子方程式_____________________。
(5)氧化铝与氢氧化钠溶液反应离子方程式:__________________________________。
【答案】2Na2O2+2CO2=2Na2CO3+O2 3Fe+4H2O(g)![]() Fe3O4+4H2 CO32-+2H+=CO2↑+H2O HCO3-+OH-=CO32-+H2O Al2O3+2OH-=2AlO2-+H2O
Fe3O4+4H2 CO32-+2H+=CO2↑+H2O HCO3-+OH-=CO32-+H2O Al2O3+2OH-=2AlO2-+H2O
【解析】
根据反应物和生成物书写反应的化学方程式或离子反应方程式。
(1)过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2。
(2)铁与水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2。
Fe3O4+4H2。
(3)碳酸钠溶液与盐酸反应生成氯化钠、二氧化碳和水,反应的离子方程式为CO32-+2H+=CO2↑+H2O。
(4)碳酸氢钠溶液与氢氧化钠溶液反应生成碳酸钠和水,反应的离子方程式为HCO3-+OH-=CO32-+H2O。
(5)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列有关叙述正确的是
A. 在标准状况下,2.24LSO3中含氧原子数为0.3NA
B. 1L0.1mol/L(NH4)2Fe(SO4)2溶液中,阳离子总数为0.3NA
C. 常温常压下,4.2g乙烯和环丙烷的混合气体中所含原子总数为0.9NA
D. 将0.1molCl2通入足量热的浓NaOH溶液中完全反应生成NaCl、NaClO3和水,转移电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定已部分变质的过氧化钠(假定杂质全部为碳酸钠)的纯度,设计了如下图所示的实验.图中Q为一具有良好弹性的气球(气球不参与反应,也不会被腐蚀),称取一定量的样品放入其中,按图安装的实验装置打开分液漏斗的活塞,将稀硫酸滴入气球中.请填空:
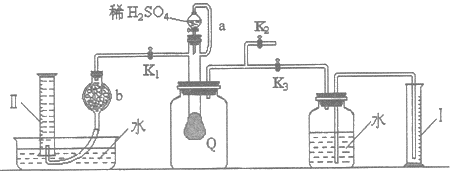
(1)Q内发生反应生成了两种气体,这两种气体的分子式为O2、CO2,写出反应的离子方程式:________。
(2)导管a的作用是________。
(3)为测定反应生成气体的总体积,滴稀硫酸前必须关闭________(填K1、K2、K3,下同),打开________。
(4)当上述反应停止后将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是________。
(5)b中装的固体试剂是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物F具有抗肿瘤、降血糖、降血压等多种生物活性,其合成路线如下:

已知:M的结构简式为: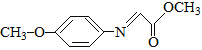 。
。
请回答下列问题:
(1)A的化学名称是_______________,B的化学式是________________。
(2)C中官能团的名称是__________________________。
(3)写出F的结构简式__________________________。
(4)已知A在一定条件下能生成可降解的聚酯,请写出该反应化学方程式:______________________________。
(5)满足下列条件的M的同分异构体有_______种(不含立体异构)。
① 能够发生银镜反应。
② 含有硝基(–NO2),且硝基直接连在苯环上。
③ 含有苯环且苯环上只有两个取代基。
其中核磁共振氢谱为四组峰且峰面积之比为6∶2∶2∶1的结构简式为________(写出一种即可)。
(6)写出用乙醛为原料制备高分子化合物聚丙烯腈的合成路线(无机试剂任选):______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.06molFeCl2加入100mLK2Cr2O7溶液中,恰好使溶液中Fe2+全部转化为Fe3+ , Cr2O72﹣还原为Cr3+ . 则K2Cr2O7溶液的物质的量浓度为( )
A.0.05mol/L
B.0.1mol/L
C.0.2mol/L
D.0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:
X(g)+ 3Y(g) ![]() 2Z(g) △H<0 当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2Z(g) △H<0 当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
选项 | 改变条件 | 新平衡与原平衡比较 |
A | 升高温度 | X的转化率变小 |
B | 增大压强 | X的浓度变小 |
C | 充入一定量Y | Y的转化率增大 |
D | 使用适当催化剂 | X的体积分数变小 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是用98%的浓H2SO4(ρ=1.84 g/cm3)配制500 mL 0.5 mol·L-1的稀硫酸的实验操作,请按要求填空:
(1) 计算所需浓硫酸的体积为________mL(保留一位小数);
(2) 如果实验室有10 mL、20 mL、50 mL的量筒,应选___________规格的量筒最好,如果量取浓硫酸时仰视读数,所配溶液浓度将(填“偏高”、“偏低”或“无影响”)___________;
(3) 将量取的浓硫酸沿烧杯内壁慢慢注入盛有约100 mL水的__里,并不断搅拌,搅拌的目的是_____;
(4) 将冷却至室温的上述溶液沿________注入________中,并用50 mL蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液要转入到容量瓶中,并振荡;
(5) 加水至距刻度线1~2 cm处,改用________加水至刻度线,使溶液的________________恰好跟容量瓶刻度线相平,把容量瓶塞好,反复颠倒振荡,摇匀溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制500mL 0.2mol·L-1的NaOH溶液:请结合实验回答下列问题:
(1)实验中需称量NaOH固体的质量为__________
(2)完成上述实验步骤要用到的玻璃仪器有烧杯、量筒、玻璃棒、__________。
(3)分析下列操作对所配制溶液浓度的影响(填 “偏高”“偏低”或“无影响”)。
①转移液体过程中有少量液体溅出:__________;
②定容时仰视刻度线:__________;
③将NaOH固体溶解后,直接转至容量瓶中进行实验:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com