
| A.常温常压下混合气体:H2、F2、NO、O2 |
| B.碱性溶液中:Na+、S2-、SO32-、CO32- |
| C.酸性溶液中:K+、Fe3+、SO32-、I- |
| D.含有0.1 mol·L-1 Ca2+的溶液中:Na+、Cu2+、SiO32-、NO3- |
科目:高中化学 来源:不详 题型:单选题
| A.在纯水中加入醋酸会促进水的电离 |
| B.1 mL pH = 2的醋酸稀释至10 mL,pH=3 |
| C.常温下,0.1 mol·L –1氯化铵溶液加水稀释,溶液中所有离子浓度均减小 |
| D.加热Na2CO3溶液能提高其除油污的能力 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AlO2-、K+、NH4+、Na+ | B.I-、Ca2+、HCO3-、Na+ |
| C.MnO4-、SO42-、K+、Al3+ | D.Na+、SO42-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO42- 和NO3-可存在于同一工厂 | B.Cl-和NO3-一定在不同的工厂 |
| C.Ag+和Na+可能在同一工 | D.Na+和NO3-来自同一工厂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AlO2—、ClO— | B.Mg2+、、SO42— | C.Fe2+、Cu2+ | D.Ba2+、K+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 金属离子 | Ksp | pH(10-1 mol?L-1) | pH(10-5 mol?L-1) |
| Fe3+ | 4.0×10-38 | 2.7 | 3.7 |
| Cr3+ | 6.0×10-31 | 4.3 | 5.6 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
| Ca2+ | 4.0×10-5 | 12.3 | 14.3 |
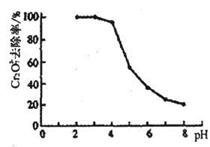
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
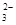 、NO3-、AlO2-
、NO3-、AlO2-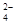
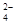
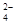 、NO3—
、NO3—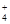 、Na+、Cl-、SCN-
、Na+、Cl-、SCN-| A.①② | B.①③ | C.②④ | D.①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com