
分析 (1)Na2CO3为强碱弱酸盐,CO3 2-水解:CO32-+H2O?HCO3-+OH-,使溶液呈碱性;
(2)FeCl3为强酸弱碱盐,Fe3+水解:Fe3++3H2O?Fe(OH)3+3H+,溶液呈酸性,氯化铁溶液蒸干,水解生成的氯化氢挥发,水解正向进行得到水解产物氢氧化铁,灼烧得到氧化铁;
(3)硫酸氢钠溶液中完全电离,溶液呈酸性,溶液pH=-lgc(H+)计算.
解答 解:(1)Na2CO3为强碱弱酸盐,CO3 2-离子水解:CO32-+H2O?HCO3-+OH-,使溶液呈碱性,pH<7,
故答案为:碱性;>; CO32-+H2O?HCO3-+OH-;
(2)FeCl3为强酸弱碱盐,Fe3+水解:Fe3++3H2O?Fe(OH)3+3H+,溶液呈酸性,PH<7,氯化铁溶液蒸干,水解生成的氯化氢挥发,水解正向进行得到水解产物氢氧化铁,灼烧得到氧化铁;
故答案为:<;Fe3++3H2O?Fe(OH)3+3H+;Fe2O3;
(3)0.01mol/L 的NaHSO4溶液中硫酸氢钠完全电离,溶液呈酸性,电离方程式为:NaHSO4=Na++H++SO42-,pH=-lg0.01=2,
故答案为:酸;NaHSO4=Na++H++SO42-;2.
点评 本题考查了盐类水解的原理分析判断,溶液酸碱性的实质分析,离子方程式书写方法,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
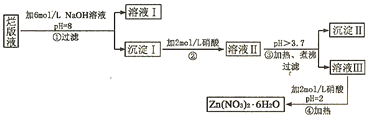
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z | B. | 气态氢化物的稳定性HX>H2Y>ZH3 | ||
| C. | 电负性:X>Y>Z | D. | 非金属性:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
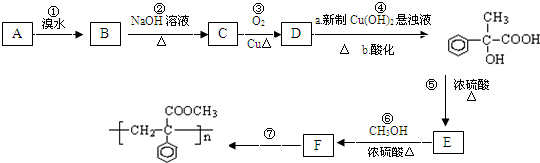
 ; F
; F 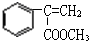 ;
;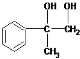 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2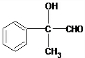 +2H2O;
+2H2O; +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$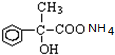 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ||||
| D |
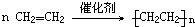
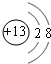 ,元素E在周期表中的位置是第3周期ⅦA族.
,元素E在周期表中的位置是第3周期ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子间作用力与化学键的键能大小相当 | |
| B. | 分子间作用力远强于化学键,是一种很强的作用 | |
| C. | 氢键主要影响物质的化学性质 | |
| D. | 分子内部的相邻原子之间强烈的相互作用称为化学键,而分子之间存在的相互作用称为分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
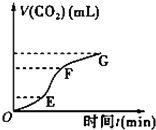 用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体.请回答问题:
用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体.请回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com