
 的名称是2-甲基丁烷;
的名称是2-甲基丁烷; ;
; .
. 分析 (1) 为烷烃,主链有4个碳原子,从离取代基近的一端编号,2号碳上有1个甲基,据此书写名称;
为烷烃,主链有4个碳原子,从离取代基近的一端编号,2号碳上有1个甲基,据此书写名称;
(2)羟基由一个氧原子和一个氢原子构成,氧原子最外层6个电子,氢原子最外层一个电子,二者形成一个共用电子对;
(3)主链为丁烯,根据烯烃的系统命名法写出该有机物的结构简式.
解答 解:(1) 为烷烃,主链有4个碳原子,从离取代基近的一端编号,2号碳上有1个甲基,名称为:2-甲基丁烷,
为烷烃,主链有4个碳原子,从离取代基近的一端编号,2号碳上有1个甲基,名称为:2-甲基丁烷,
故答案为:2-甲基丁烷;
(2)从羟基的中心原子O周围7个电子,羟基中存在一对共用电子对,羟基的电子式为 ,
,
故答案为: ;
;
(3)顺-2丁烯,主链为丁烯,两个甲基位于双键的同侧,结构简式为: ,
,
故答案为: .
.
点评 本题考查了等电子式、有机化合物的命名,顺反结构等,题目难度中等,注意掌握常见化学用语的表示方法,掌握有机物的命名原则.


 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:选择题
| A. | 道尔顿:分子学说 | B. | 汤姆生:射线的发现 | ||
| C. | 卢瑟福:原子结构的行星模型 | D. | 伦琴:原子的葡萄干面包模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备硫酸:使用热交换器可以充分利用能量 | |
| B. | 侯德榜制碱:析出NaHCO3的母液中加入消石灰,可以循环利用NH3 | |
| C. | 合成氨:采用500℃的高温,有利于增大反应正向进行的程度 | |
| D. | 合成氯化氢:通入H2的量略大于Cl2,可以使平衡正移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑥ | C. | ①②⑤ | D. | ①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
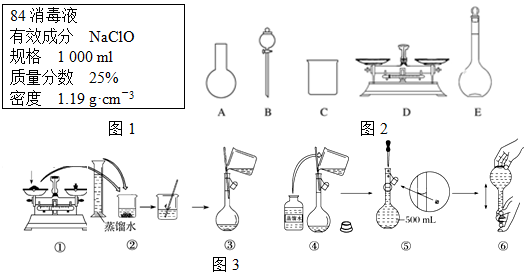
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Cu═2FeCl2+CuCl2
现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Cu═2FeCl2+CuCl2查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电子式表示HCl的形成过程: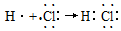 | |
| B. | ${\;}_{87}^{166}$Ho中的原子核内的中子数与核外电子数之差是99 | |
| C. | 在空气中加热金属锂:4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O | |
| D. | Na2O2与H2O2中所含的化学键类型不完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com