

| A. | 铜片表面有气泡生成,且铜片为正极,为电子流入的一极 | |
| B. | 如果将硫酸换成苹果汁,导线中不会有电子流动 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将锌片换成铁片,电路中的电流方向由铜片经导线流向铁片,铁片发生氧化反应 |
分析 A.铜锌原电池中,Cu作正极,电子从负极流向正极;
B.苹果汁显酸性也能作电解质溶液;
C.根据图中能量转化分析;
D.将锌片换成铁片,铁比铜活泼,则铁作负极,铜为正极;
解答 解:A.铜锌原电池中,Cu作正极,溶液中的氢离子在正极上得电子生成氢气,所以Cu上有气泡生成,电子从负极流向正极,所以铜片为正极,为电子流入的一极,故A正确;
B.苹果汁显酸性也能作电解质溶液,所以将硫酸换成苹果汁,仍然构成原电池,所以导线中有电子流到,故B错误;
C.原电池中化学能转化为电能,LED灯发光时,电能转化为光能,故C正确;
D.将锌片换成铁片,铁比铜活泼,则铁作负极,铜为正极,则电路中的电流方向由铜片经导线流向铁片,铁片发生氧化反应,故D正确;
故选B.
点评 本题考查了原电池原理,明确正负极的判断方法以及能量的转化即可解答,可以从电子流向、电极上得失电子、电极上发生反应类型来判断正负极,难度不大.


科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | C-O | C═O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
| A. | 403 kJ•mol-1,-66 kJ•mol-1 | B. | 423 kJ•mol-1,+28 kJ•mol-1 | ||
| C. | 314 kJ•mol-1,-18 kJ•mol-1 | D. | 413 kJ•mol-1,-58 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O的相对分子质量是18克 | |
| B. | H2O的摩尔质量是18克 | |
| C. | 标准状况下H2O的摩尔体积是22.4L.mol-1 | |
| D. | 1mol H2O的质量是18克 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,属于芳香烃的是c(填字母),它与苯的关系是同系物,写出苯与溴发生反应的化学方程式
,属于芳香烃的是c(填字母),它与苯的关系是同系物,写出苯与溴发生反应的化学方程式 ,预测该芳香烃能(填“能”或“不能”)发生该类反应.
,预测该芳香烃能(填“能”或“不能”)发生该类反应.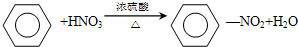 ,属于取代反应.③由苯制取环己烷:
,属于取代反应.③由苯制取环己烷: ,属于加成反应.
,属于加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间 实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | T | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com