
元素的原子结构决定其性质和在周期表中的位置,下列说法正确的是
A.元素原子的最外层电子数一定等于元素的最高化合价
B.多电子原子中,在离核较近的区域内运动的电子能量较高
C.P、S、Cl 得电子能力和最高价氧化物水化物的酸性均依次增强
D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
混合气体由O2和CH4组成,测得混合气体在标准状况下的密度为1.25g/L,则混合气体中O2和CH4的体积之比为( )
|
| A. | 3:1 | B. | 1:3 | C. | 4:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
NaHSO4在水溶液中能够电离出H+、Na+、SO42- 。下列对于NaHSO4的分类中不正确的是( )
A、NaHSO4是盐 B、NaHSO4是酸
C、NaHSO4是钠盐 D、NaHSO4是酸式盐
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于胶体的说法不正确的是( )
A.制备Fe(OH)3胶体后可以用渗析的方法净化
B.利用丁达尔效应可以区分溶液和胶体
C.电泳现象可证明胶体都带电
D.胶体是分散质粒子直径在1~100 nm之间的分散系
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.氨气分子是极性分子而甲烷是非极性分子。
D.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
查看答案和解析>>
科目:高中化学 来源: 题型:
北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的球碳盐K3C60。实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构分析正确的是
A. K3C60中既有离子键又有极性键 B.1mol K3C60中含有的离子数目为63×6.02×1023
C.该晶体在熔融状态下能导电 D.该物质的化学式可写作KC20
查看答案和解析>>
科目:高中化学 来源: 题型:
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是
 |
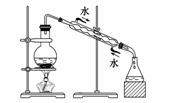
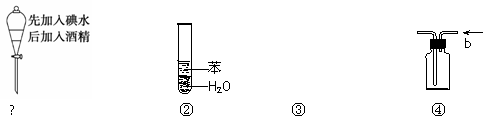 |
A.溶液上层无色,下层紫红色
B.装置②可用于吸收HCl气体,并防止倒吸
 C.装置③可用于制取蒸馏水
C.装置③可用于制取蒸馏水
D.装置④ b口进气可收集H2、CO2等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质提纯的方法正确的是
A.除去混在NO2中的NO:将气体与足量O2混合
B.除去混在CO2中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸
C.除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤
D.除去乙酸中混有的乙醇:加入生石灰后蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com