
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H=+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H= 566.0 kJ·mol-1
566.0 kJ·mol-1
 反应CO2(g)+CH4(g)
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_____________________
②为了提高该反应中CH4的转化率,可以采取的措施是________________________
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为___________________________
(3)Li2O、Na2O、MgO均能吸收CO2。①如果寻找吸收CO2的其他物质,下列建议合理的是______
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是___________________________
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:
高温电解技术能高效实现(3)中反应A,工作原理示意图如下:
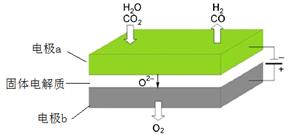
CO2在电极a放电的反应式是_____________________________________________
【知识点】反应热的计算、化学平衡常数的含义、化学平衡的影响因素、电解原理
【答案解析】⑴①64 ②+247.3 kJ·mol-1
⑵①温度超过250℃时,催化剂的催化效率降低
②增大反应压强或增大CO2的浓度
③3Cu2Al2O4+32H++2NO3-=6Cu2++ 6Al3++2NO↑+16 H2O
(3)①ab (1分) ②CO2 + Li4SiO4  Li2CO3 + Li2SiO3
Li2CO3 + Li2SiO3
(4)CO2 + 2e- == CO+O2-
解析:(1)① CO2(g)+CH4(g)⇌2CO(g)+2H2(g)
起始(mol) 6 6 0 0
反应(mol) X X 2X 2X
平衡(mol) 6-X 6-X 2X 2X
由CH4的体积分数为0.1,则(6-x)/(12+2x)=0.1,解得X=4,所以K=(22×22)/(0.5×0.5)=64
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 ①
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=2.8kJ•mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1 ③
根据盖斯定律,由①+②×2-③×2得
CO2(g)+CH4(g)⇌2CO(g)+2H2(g)△H=(-890.3+2.8×2+566.0×2) kJ•mol-1=+247.3 kJ•mol-1;
(2)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低;
②增大反应压强、增大CO2的浓度,平衡正向移动,反应物转化率增大;
③Cu2Al2O4拆成氧化物的形式:Cu2O•Al2O3,与酸反应生成离子方程式:
3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O;
(3)①a.Li2O、Na2O、MgO均属于碱性氧化物,均能吸收酸性氧化物CO2,可在碱性氧化物中寻找吸收CO2的其他物质,故a正确;
b.Li2O、Na2O、MgO均能吸收CO2,钠、镁、铝为ⅠA、ⅡA族元素,所以可在ⅠA、ⅡA族元素形成的氧化物中寻找吸收CO2的其他物质,故b正确;
c.Li2O、Na2O、MgO均能吸收CO2,但它们都没有强氧化性,且吸收二氧化碳与氧化还原无关,故c错误; 故答案为:ab;
②在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,所以化学方程式为CO2 + Li4SiO4  Li2CO3 + Li2SiO3;
Li2CO3 + Li2SiO3;
(4)二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e-═CO+O2-;
【思路点拨】本题主要考查了综合利用CO2,涉及热化学反应、电化学、化学平衡影响因素等,较为综合,题目难度中等.


科目:高中化学 来源: 题型:
对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物:
CH4 (g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-570 kJ·mol-1
CH4(g)+4NO(g)===2 N2(g) +CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
请写出CH4 与NO2生成无毒气体的热化学方程式:
_________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是 ( )
A.与W相邻的同主族元素可制成重要的半导体材料
B.X单质不可能置换出W单质
C.元素原子半径从大到小的顺序是X、Y、Z
D.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HZO4
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习兴趣小组讨论辨析以下说法,其中说法正确的是( )
①通过化学变化可以实现16O与18O间的相互转化
②灼烧钠的化合物时,火焰呈黄色,发生化学反应
③碱性氧化物一定是金属氧化物
④只由一种元素组成的物质一定为纯净物
⑤石墨和C60是同素异形体
⑥糖类、蛋白质、油脂属于天然高分子化合物
A.③⑤⑥ B.①② C.③⑤ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
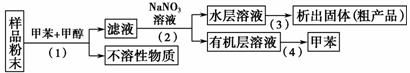
下列说法错误的是( )
A.步骤(1)需要过滤装置 B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚 D.步骤(4)需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源: 题型:
对铜—锌—稀硫酸组成的原电池装置中,当导线中有1mol电子通过时,理论上的两极变化是①锌片溶解了32.5克 ②锌片增重了32.5克 ③铜片上析出1克氢气④铜片上析出1mol氢气
A. ①③ B.①④ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生;②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生还原反应;③把A、C用导线连接后同时浸入稀硫酸溶液中,电子流动方向A→导线→C。根据上述情况,回答下列问题:
(1)在①中,金属片 发生氧化反应;
(2)在②中,金属片 作负极;
(3)如果把B、D用导线连接后同时浸入稀硫酸溶液,则金属片 上有气泡产生;
(4)上述四种金属的活动性顺序是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com