
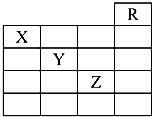
 如图是元素周期表的一部分,关于元素X、Y、Z的叙述中,正确的个数是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述中,正确的个数是( )| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
分析 如图是元素周期表的一部分,则R为He、X为氮元素、Y为硫元素、Z为Br元素,
①氨气与硫酸反应可以生成硫酸铵;
②氨气的水溶液显碱性;
③常温下,溴为液体;
④Br所在的周期中含有18种元素.
解答 解:如图是元素周期表的一部分,则R为He、X为氮元素、Y为硫元素、Z为Br元素,
①氨气与硫酸反应可以生成硫酸铵,硫酸铵为盐,故正确;
②氨水溶液显碱性,HBr溶液显酸性,故错误;
③溴常温下为液体,故正确;
④Br处于第四周期,所在的周期中含有18种元素,故错误,
故选C.
点评 本题考查位置、结构、性质及用途,为高频考点,把握元素的位置、元素及化合物的性质为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
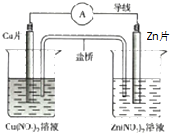
| A. | 盐桥中阴离子向正极移动 | |
| B. | 正极的电极反应是:Zn2++2e-═Zn | |
| C. | Zn片上发生氧化反应 | |
| D. | 用该电池电解水,析出3.2gCu时生成1.12LO2(标况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 物质 | 杂质 | 所加试剂 | 分离方法 | 离子方程式 |
| 1. | NO | NO2 | |||
| 2. | Fe粉 | Al粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
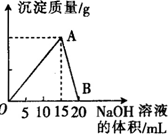 向20mL 某浓度的AlCl3溶液中滴入2mol•L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL 某浓度的AlCl3溶液中滴入2mol•L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | C-C | C=C | C≡C |
| 键长(nm) | 0.154 | 0.134 | 0.120 |
| 键能(kJ/mol) | 347 | 612 | 838 |
| A. | 0.154 nm>苯中碳碳键键长>0.134nm | |
| B. | C=O键键能>C-O键键能 | |
| C. | 乙烯的沸点高于乙烷 | |
| D. | 烯烃比炔烃更易与溴加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com