
【题目】一种类似钻石的装饰品——锆石(ZrSiO4),其做为装饰品,价格低廉,外观璀璨。天然锆石中常含有Fe、Al、Cu的氧化物杂质,称为锆英石。工业上一种以锆英石为原料制备ZrO2的工艺流程如下:
Ⅰ. Zr在化合物中通常显![]() 价,氯化过程中除C、O元素外,其它元素均转化为其高价氯化物;
价,氯化过程中除C、O元素外,其它元素均转化为其高价氯化物;
Ⅱ.SiCl4极易水解生成硅酸;ZrCl4易溶于水,400℃升华
Ⅲ.Fe(SCN)3难溶于MIBK,Zr (SCN) 4在水中的溶解度小于在MIBK中的溶解度。
请回答下列问题
(1)滤渣1的主要成分是:______________
(2)①“氯化”过程中,锆石(ZrSiO4)发生反应的化学方程式为______________
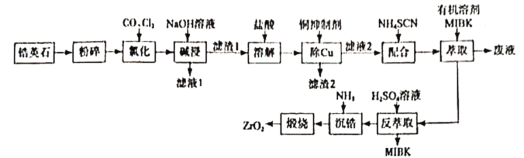
②ZrCl4产率随温度、压强的变化如图所示,回答问题
“氯化”过程选择的最佳条件为_______;“氯化”环节产率随温度升高先增大后减小的原因为______
(3)“滤液1”中含有的阴离子,除OH-外还有____________________
(4)①常用的铜抑制剂为NaCN (氰化钠),NaCN可与重金属阳离子反应,生成溶度积较小的沉淀(如Cu(CN)2,Ksp=4×10-10),已知盐酸溶解后的溶液中Cu2+的浓度为1mol/L,若需要溶液中Cu2+浓度等于1.0×10-6 mol/L,则预处理1L该溶液需要1mol/LNaCN溶液的体积为_____________(假设溶液混合后体积可以相加,计算结果保留两位小数)
②由于氰化钠有剧毒,因此需要对“废液”中的氰化钠进行处理,通常选用漂白粉或漂白液在碱性条件下将其氧化,其中一种产物为空气的主要成分,则在碱性条件下漂白液与氰化钠反应的离子方程式为_____________
【答案】Zr (OH) 4 ZrSiO4+4Cl2+4CO=ZrCl4+SiCl4+4CO2 1×106Pa,390℃ 温度升高,化学反应速率加快,相同的时间内生成的产物更多;温度过高,产物升华,产率降低 SiO32-、AlO2-、Cl- 2.06L 2CN-+5ClO-+2OH-=2CO32-+5Cl-+N2↑+H2O
【解析】
天然锆石经过粉碎后,加入CO、Cl2,ZrSiO4反应为ZrC14和SiCl4,其它金属变为FeCl3、AlCl3、CuCl2。加入NaOH后,滤液中含有NaOH、NaCl、NaAlO2、Na2SiO3,沉淀中主要有Fe(OH)3、Zr(OH)4、Cu(OH)2。加入HCl后,Fe(OH)3、Cu(OH)2、Zr(OH)4溶于HCl。加入Cu抑制剂,除去Cu杂质。加入NH4SCN后,Fe3+和Zr4+形成配合物Fe(SCN)3、Zr(SCN)4。加入有机溶剂MIBK,将Zr(SCN)4萃取到有机层,再用H2SO4将Zr(SCN)4萃取到水层,通入NH3,生成Zr(OH)4,煅烧后得到ZrO2。
(1)滤渣1中含有Zr(OH)4、Fe(OH)3、Cu(OH)2,主要成分是Zr(OH)4;
(2)①根据信息,“氯化”过程中,ZrSiO4与氯气、CO反应的生成物中含有ZrC14、SiCl4,同时根据氧化还原反应原理可知生成物中还含有CO2,故反应的化学方程式为ZrSiO4+2Cl2+4CO=ZrC14+SiCl4+4CO2;
②观察图像可知产率最高点时的压强和温度分别是1×106Pa,390℃;“氯化”环节产率随温度升高先增大后减小的原因为温度升高,化学反应速率加快,相同的时间内生成的产物更多;温度过高,产物升华,产率降低;
(3)“滤液1”中含有NaOH、NaCl、NaAlO2、Na2SiO3,阴离子除OH-外还有SiO32-、AlO2-、Cl-;
(4)①沉淀Cu2+需要2 L 1 mol/L NaCN溶液,根据Ksp=c( Cu2+)×c2(CN-),代入Ksp=4×10-10、c(Cu2+)=1.0×10-6 mol/L计算,可得最终混合液中c(CN-)=2.0×10-2mol/L。设所需体积为(2+x)L,则有x=2.00×10-2×(3+x),计算得x≈0.06,所以最终需要2.06 L溶液;
②)漂白液或漂白液的有效成分都含有ClO-,由题意知氮元素氧化生成N2,碳元素氧化生成CO32-, ClO-还原成Cl-,结合原子个数守恒、电子守恒进行配平,发生反应的离子方程式为2CN-+5ClO-+2OH-=2CO32-+5Cl-+N2↑+H2O。


科目:高中化学 来源: 题型:
【题目】香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下:

下列说法正确的是( )
A. 反应1→2属于加成反应,且生成的化合物2具有一个手性碳原子
B. 化合物2在一定条件下可发生消去反应
C. 检验制得的香草醛中是否混有化合物3,可用氯化铁溶液
D. 等物质的量四种化合物分别与足量NaOH反应,消耗NaOH物质的量之比为1:3:2:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如图:
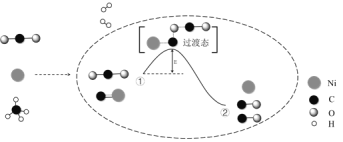
下列说法中错误的是( )
A.过程①→②是吸热反应
B.Ni是该反应的催化剂
C.过程①→②既有碳氧键的断裂,又有碳氧键的形成
D.反应的总化学方程式可表示为:CH4+CO2![]() 2CO+2H2
2CO+2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用标准盐酸测定某NaOH溶液的浓度,用酚酞作指示剂,下列操作可能使测定结果偏低的是
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2—3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由红色变无色时,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2—3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有稀 | 试管口出现红棕色气体 | 溶液中的 |
B | 向某钠盐X溶液中加入盐酸,将产生的气体通入 | 有白色沉淀产生 | 反应生成的气体可能为 |
C | 向滴加酚酞的氨水中加蒸馏水稀释 | 溶液红色变浅 | 溶液中所有离子的浓度均减小 |
D | 用铂丝蘸取某溶液在酒精灯火焰上灼烧 | 直接观察,火焰呈黄色 | 溶液中的金属阳离子只有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示。下列说法正确的是
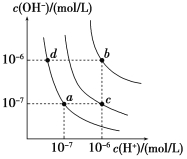
A. 图中对应点的温度关系为a>b>c
B. 纯水仅升高温度,可从a点变到c点
C. 水的离子积常数Kw数值大小关系为b>c>d
D. 在b点对应温度下,0.5 mol/L的H2SO4溶液与1 mol/L的KOH溶液等体积混合,充分反应后,所得溶液的c(H+)=1.0×107 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25 ℃和95 ℃时的电离平衡曲线如图所示:

(1)25 ℃时水的电离平衡曲线应为__________ (填“A”或“B”)。
(2)95 ℃时水的离子积Kw=__________,c(H+)=__________
(3)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_____。
(4)95 ℃时,若100 mL pH1=a的某强酸溶液与1 mL pH2=b的某强碱溶液混合后,所得溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的化学用语表达正确的是( )
A | Mg(HCO3)2溶液与足量的NaOH溶液反应 | Mg2++2HCO |
B | 过量SO2通入到NaClO溶液中: | SO2+H2O+ClO-===HClO+ |
C | 向Al2(SO4)3溶液中加入过量的稀氨水 | Al3 ++4NH3·H2O=AlO2—+4NH4++2H2O |
D | KClO碱性溶液与Fe(OH)3反应制取K2FeO4 | 3ClO﹣+2Fe(OH)3=2FeO42﹣+3Cl﹣+4H++H2O |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化钪(Sc2O3)是一种稀土氧化物,可用于制作激光、半导体材料。以钪锰矿石(主要含MnO2、SiO2及少量Sc2O3、Al2O3、CaO、FeO)为原料制备Sc2O3的工艺流程如图,其中TBP和P507均为有机萃取剂。

回答下列问题:
(1)Sc2O3中Sc的化合价为___。
(2)“溶解”时铁屑被MnO2氧化为Fe3+,该反应的离子方程式是___。
(3)“滤渣”的主要成分是___。
(4)“萃取除铁”时铁和钪的萃取率与O/A比(有机相与水相的体积比)的关系如图所示。该工艺中最佳O/A比为___。
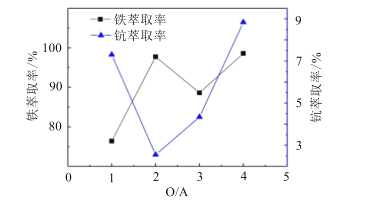
(5)有机萃取剂P507萃取Sc3+的反应原理为阳离子交换:ScCl3+3HR=ScR3+3HCl(HR代表P507)。在“富钪有机相”中反应生成Sc(OH)3的化学方程式是___。
(6)“萃余液2”中的金属阳离子除Al3+、Ca2+外,还有___。
(7)Sc2(C2O4)3在空气中“煅烧”生成Sc2O3的化学方程式是___。
(8)某厂用1000kg的钪锰矿制备Sc2O3,最终得到Sc2O3306g,该矿中含钪的质量分数为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com