
| A. | 通入澄清石灰水 | B. | 用品红溶液 | ||
| C. | 用湿润的蓝色石蕊试纸 | D. | 根据有无毒性 |
科目:高中化学 来源: 题型:选择题
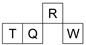 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 原子半径:T>Q>R | |
| C. | 最高价氧化物对应水化物的酸性:Q<W | |
| D. | 含T元素的盐溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
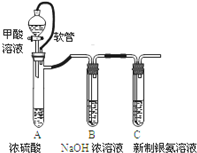 | 已知:①银氨溶液的化学式为: Ag(NH3)2OH ②反应结束后试管C底部有黑色 沉淀生成, ③分离出上层清液和底部黑色 固体备用. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BF2Cl只有一种结构 | B. | 三根B-F键间键角都为120° | ||
| C. | BFCl2只有一种结构 | D. | 三根B-F键键长都为130pm |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某同学研究铜与浓硫酸的反应装置:
如图是某同学研究铜与浓硫酸的反应装置:| 实验装置 | 实验现象 |
 | 品红褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


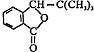
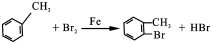 ,F的结构简式
,F的结构简式 .
.
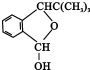 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com