

请回答:
(1)写出C的化学式:_______________。
(2)写出Y+G![]() W+Z的化学反应方程式,并标明电子转移的方向和数目:____________________________________________________________。
W+Z的化学反应方程式,并标明电子转移的方向和数目:____________________________________________________________。
(3)写出电解D的饱和水溶液的离子方程式:____________________________________。
(4)用电子式表示Z的形成过程:____________。
科目:高中化学 来源: 题型:
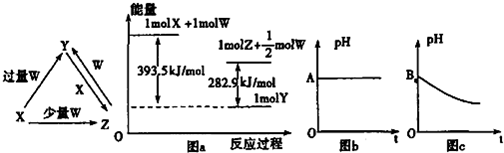
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
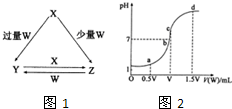 (2013?菏泽二模)X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图1所示(水及部分产物已略去).
(2013?菏泽二模)X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图1所示(水及部分产物已略去). 查看答案和解析>>
科目:高中化学 来源: 题型:

(1)若A是一种紫红色金属,气体D能使品红溶液褪色,加热时又恢复原色。写出反应①的化学方程式:_________________________。气体D与另一种气体H混合后生成一种淡黄色固体W,写出该反应的化学方程式:____________________________,其中氧化产物和还原产物物质的量之比为______________________。
(2)若A是一种金属单质,D是最轻的气体,B能否是NaOH溶液_____________(填“能”或“否”)。
(3)若A是金属单质,D是一种无色气体,遇到空气变为红棕色,液体C呈蓝色。写出反应①的离子方程式:__________________________________。写出反应②的任意一个离子方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省菏泽市高三5月份模拟考试化学试卷(解析版) 题型:推断题
X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(水及部分产物已略去)。
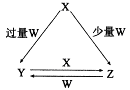
(1)若X为金属单质,W是某强酸的稀溶液。X与少量W反应生成Z的离子方程式为 ,向Y溶液中加入某种试剂 (填试剂名称),若溶液出现血红色,即可判断Y溶液中阳离子的存在。
(2)若X、Y为正盐,X的水溶液显酸性,W为NaOH溶液,写出Y与X在水溶液中转化为Z的离子反应方程式 。
(3)若X为强碱,常温下W为有刺激性气味的气态氧化物。常温时,将Z的水溶液露置于空气中,溶液的PH变化是 (填“变大”、“变小”、“不变”。不考虑水的挥发),其原因是_________ (用简要的文字说明,并写出离子方程式)。
(4)室温下,若用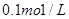 的NaOH溶液滴定
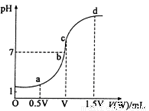
的NaOH溶液滴定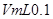 mo1/L HA溶液,滴定曲线如图所示,则a、b、c、d四点溶液中水的电离程度最大的是
点;a点溶液中离子浓度的大小顺序为
;少量c点溶液于试管中,再滴加0.1mo1/L盐酸至中性,此时溶液中除H+、OH-外 ,离子浓度的大小顺序为 。
mo1/L HA溶液,滴定曲线如图所示,则a、b、c、d四点溶液中水的电离程度最大的是
点;a点溶液中离子浓度的大小顺序为
;少量c点溶液于试管中,再滴加0.1mo1/L盐酸至中性,此时溶液中除H+、OH-外 ,离子浓度的大小顺序为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com