
【题目】用Na2CO3·10H2O晶体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1)应称取Na2CO3·10H2O晶体的质量:____________。定容时,向容量瓶中加水,至1~2cm时,改用_________加水至刻度,加盖摇匀;
(2)根据下列操作对所配溶液的浓度产生的影响,完成下列要求:
①Na2CO3·10H2O晶体失去了部分结晶水 ②用“左码右物”的称量方法称量晶体(使用游码) ③碳酸钠晶体不纯,其中混有氯化钠 ④称量碳酸钠晶体时所用砝码生锈 ⑤容量瓶未经干燥使用。 其中引起所配溶液浓度偏高的有______________(填序号,下同),偏低的有______________,无影响的有_______________________________。
(3)下列操作中,容量瓶所不具备的功能有________________。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体 D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(4)某同学改用固体Na2CO3配制上述Na2CO3溶液的过程如图所示:

你认为该同学的错误步骤有_________________。
A.1处 B.2处 C.3处 D.4处
【答案】 28.6 g 胶头滴管 ①④ ②③ ⑤ B、C、E B
【解析】(1)配制0.2molL-1的Na2CO3溶液480mL,应选择500mL容量瓶,实际配制500mL溶液,需要Na2CO3物质的量为:0.2molL-1×0.5L=0.1mol,根据1molNa2CO310H2O能提供1molNa2CO3,可知需要的Na2CO310H2O的物质的量n=0.1mol,根据m=nM=0.1mol×286g/mol=28.6g,定容时,为防止加入蒸馏水过多,所以向容量瓶中加水,至1~2cm时,改用胶头滴管加水至刻度,加盖摇匀;故答案为:28.6g;胶头滴管;
(2)①碳酸钠晶体失去了部分结晶水,溶质的质量偏大,溶质的物质的量偏大,则配制溶液浓度偏高;②用“左码右物”的称量方法称量晶体,溶质的质量偏低,溶质的物质的量偏低,则配制溶液浓度偏低;③碳酸钠晶体不纯,其中混有氯化钠,溶质的质量偏低,溶质的物质的量偏低,则配制溶液浓度偏低,;④称量碳酸钠晶体时所用砝码生锈,溶质的质量偏大,溶质的物质的量偏大,则配制溶液浓度偏高;⑤容量瓶未经干燥就使用,溶质的物质的量和溶液的体积都不改变,所以配制溶液浓度不变;故答案为:①④;②③;⑤;
(3)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,故选BCE;
(4)在第③步和第④步之间还需要洗涤烧杯和玻璃杯,第⑤定容时,视线要与容量瓶中的凹液面相平,所以总共两处错误,故选B。


科目:高中化学 来源: 题型:
【题目】(1)水溶液中的离子平衡是中学化学的重要知识。
①25℃时,Na2CO3溶液呈碱性,原因是___________水解引起的(填“Na+”或“CO32-”);升高温度可以__________(填“促进”或“抑制”)Na2CO3的水解;
②常温下,pH=2的盐酸,该溶液中c( HCl )= _________________ mol/L;
(2)12g碳与适量水蒸气反应生成CO和H2,需吸收131.3kJ热量,此反应的热化学方程式为_____________________(填字母代号)。
A.C + H2O == CO + H2 ΔH= +131.3 kJ·mol-1
B. C(s)+ H2O(g) == CO(g) + H2(g) ΔH= +10.94 kJ·mol-1
C. C(s)+ H2O(g) == CO(g) + H2(g) ΔH= +131.3 kJ·mol-1
体积为1 L的容恒密闭容器中,充入1.00 mol CO2和3.00 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.00 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.00 kJ·mol-1
测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
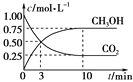
①从反应开始到平衡,二氧化碳的平均反应速率v(CO2)=______mol·(L·min)-1;
②该反应的平衡常数的表达式K= ___________________________;
③能说明该反应达到化学平衡状态的是__________(填字母代号);
A.c(CO2) = c(H2O) B.单位时间内消耗3mol H2,同时生成1mol CH3OH
C.容器内气体的压强不再变化
④下列措施中能使n(CH3OH)/n(CO2)增大的是________。
A.升高温度 B.将H2O(g)从体系中分离 C.再充入1.00 mol CO2
(4)下图是实验室电解精炼铜装置,
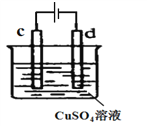
①d的电极材料为________________(填“粗铜”或“精铜”);
②c的电极反应方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H=-1025kJ.mo1-1,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
4NO(g)+6H2O(g)△H=-1025kJ.mo1-1,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
A.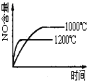 B.
B.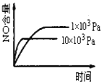 C.
C.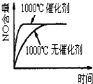 D.
D.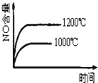
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是一种强氧化剂,在实验室和工业中都有很广泛的应用。同时,由于其具有致癌作用,也是环境污染物之一,必须进行处理。工业上通常以铬铁矿(主要成分为FeOCr2O3,另外还含有SiO2、Al2O3等杂质)为原料制备重铬酸钾,主要流程如下图所示:
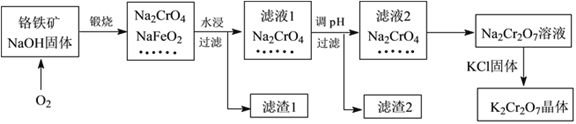
已知:①NaFeO2遇水强烈水解,生成红褐色物质;
②2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
请回答下列问题:
Ⅰ.(1)滤液1的溶质除Na2CrO4、Na2SiO3外,还含有(填化学式)_________________;
(2)由滤液2转化为Na2Cr2O7溶液过程中,能说明反应达平衡状态的是_______(填字母代号);
a.溶液的颜色不变
b.v (CrO42—)= 2v (Cr2O72—)
c.Cr2O72—和CrO42—的浓度相同
(3)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、______________、过滤、洗涤、干燥。
Ⅱ.工业废水中常含有一定量的Cr2O72—和CrO42—,常用还原沉淀法处理。该方法的工艺流程为:
![]()
(4)请写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式___________________;
(5)已知常温下,Cr(OH)3的溶度积Ksp=10-32,要使第步过程中c(Cr3+)降至10-5mol/L,溶液的pH应调至__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于微粒半径大小的下列叙述中不正确的是
A. 同一元素的不同粒子,核外电子数越多,半径越大
B. 同一元素形成的多种价态的离子,价态越低,半径越小
C. 同一元素的原子半径小于相应的阴离子半径
D. 同一元素的原子半径大于相应的阳离子半径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硝酸银与氯化钾反应生成硝酸钾和不溶于水的氯化银,化学方程式为AgNO3+KCl=AgCl↓+KNO3。将含有少量氯化钾的硝酸钾固体提纯,某学生如图所示的实验操作。回答下列问题:

(1)将样品置于烧杯中,加入适量的水溶解,同时用玻璃棒搅拌,搅拌的作用是___________。
(2)向溶液中加入适量的________溶液,使氯化钾转化为沉淀。
(3)将混合液进行过滤,过滤装置和操作如图所示,指出图中的两处错误:①__________________;②______________________。
(4)为了从液体中得到硝酸钾晶体,可选用的两种结晶方法是:① __________________________ ;②______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到反应限度的标志是 ( )
2AB(g)达到反应限度的标志是 ( )
A. 容器内的总压强不随时间变化 B. 单位时间内生成2n molAB的同时生成n molB2
C. c(A2):(B2):c(AB)=1:1:2 D. A2和B2的物质的量之和与AB的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正在研制的一种“高容量、低成本”锂-铜空气燃料电池,该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程2Li+Cu2O+H2O=2Cu+2Li++20H-,下列说法不正确的是

A. 放电一段时间后右侧水溶液pH升高
B. 整个反应过程中,铜相当于催化剂
C. 通空气时,铜被腐蚀,表面产生CuO
D. 放电时,正极的电极反应式为 Cu2O+H2O+2e-=Cu+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 做衣服的棉、麻、蚕丝的主要成分都是纤维素
B. 油脂在碱性条件下的水解为皂化反应
C. 石油的分馏和煤的干馏都是物理变化
D. 饱和Na2SO4、CuSO4溶液均可用于蛋白质的盐析
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com