
| 编号 | 实验操作 | 实验现象 | 解释与结论 |
| A | 铜与浓硝酸反应,生成气体用湿润KI-淀粉试纸检验 | 试纸变蓝 | NO2为酸性气体 |
| B | 向某溶液中加入稀盐酸酸化的BaCl2溶液 | 有白色沉淀产生 | 该沉淀可能是BaSO4,该溶液中可能含有SO42- |
| C | 向甲苯中滴入少量浓溴水,振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色 | 甲苯和溴水发生取代反应,使溴水褪色 |
| D | 在稀AgNO3溶液中先加入过量0.1mol/L NaCl溶液,再加入少量0.1mol/L NaI溶液 | 先产生白色沉淀,后出现黄色沉淀 | 说明Ksp(AgCl)>Ksp(AgI) |
科目:高中化学 来源:不详 题型:单选题
 Ag+(aq)+Br-(aq)。则下列说法正确的是( )
Ag+(aq)+Br-(aq)。则下列说法正确的是( )| A.向此体系中滴加足量浓NaCl溶液,发现沉淀转化为白色,说明Ksp(AgCl)<Ksp(AgBr) |
| B.向此体系中加入少量AgBr固体,平衡正向移动,当再次平衡时c(Ag+)、c(Br-)增大 |
| C.此体系中一定存在c(Ag+)=c(Br-)=[Ksp(AgBr)]1/2 |
| D.某溶液中c(Ag+)·c(Br-)=Ksp(AgBr),说明此时c(Ag+)=c(Br-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同温度下,CuS的溶解度大于ZnS的溶解度 |
| B.将足量CuSO4溶解在0.1 mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol·L-1 |
| C.因为H2SO4是强酸,故CuSO4+H2S=CuS↓+H2SO4不能发生 |
| D.除去工业废水中的Cu2+,可以选用FeS作沉淀剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.MnS的Ksp比CuS的Ksp大 |
| B.该反应达平衡时c(Mn2+)=c(Cu2+) |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数K= |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A | B | C | D |
 |  |  |  |
| 装置能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 | 制备少量氨气 | 制备并收集少量NO2气体 | 制备少量氧气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B.在100mL MgCO3、CaCO3、MnCO3饱和的混和溶液中加入足量浓K2CO3溶液,产生沉淀MnCO3质量最多 |
| C.b点可表示CaCO3的饱和溶液,且Ca2+浓度与CO32-浓度相等 |
| D.c点若表示MgCO3则为不饱和溶液,若表示CaCO3则有沉淀析出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.原AgNO3溶液的物质的量浓度为0.1 mol·L-1 |
| B.图中x点的坐标为(100,6 ) |
| C.图中x点表示溶液中Ag+ 与Cl- 浓度相同 |
| D.把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI则图象在终点后变为虚线部分 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
| A.Ksp(CuCO3)<Ksp(CaCO3) | B.c(Cu2+)<c(Ca2+) |
C.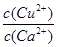 > > | D.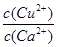 < < |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com