
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A.1 mol·L-1的甲酸溶液的c(H+)为1×10-2 mol·L-1 |
| B.甲酸能与水以任意比互溶 |
| C.10 mL 1 mol·L-1的甲酸溶液恰好与10 mL 1 mol·L-1的NaOH溶液完全反应 |
| D.滴入石蕊试液显红色 |
科目:高中化学 来源: 题型:单选题
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如表,下列叙述正确的是
| 酸 | 电离平衡常数 |
| 醋酸 | K i=1.75×10-5 |
| 次氯酸 | K i=2.98×10-8 |
| 碳酸 | Ki1=4.30×10-7 Ki2=5.61×10-11 |
| 亚硫酸 | Ki1=1.54×10-2 Ki2=1.02×10-7 |
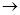 SO32— + 2HClO
SO32— + 2HClO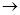 HCO3— + HClO
HCO3— + HClO查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1盐酸,如达到滴定终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是( )
| A.4 | B.7.2 | C.10 | D.11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
以甲基橙为指示剂,用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,
滴定过程中不可能出现的结果是( )
| A.c(NH4+)>c(Cl-),c(OH-)>c(H+) |
| B.c(NH4+)=c(Cl-),c(OH-)=c(H+) |
| C.c(Cl-)>c(NH4+),c(OH-)>c(H+) |
| D.c(Cl-)>c(NH4+),c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
水的电离过程为H2O H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
| A.c(H+)随着温度的升高而降低 |
| B.35 ℃时c(H+)>c(OH-) |
| C.35 ℃时的水比25 ℃时的水电离程度小 |
| D.水的电离是个吸热过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,有下列四种溶液:
| ① | ② | ③ | ④ |
| 0.1 mol·L-1NaOH溶液 | pH=11 NaOH溶液 | 0.1mol·L-1 CH3COOH溶液 | pH=3 CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在0.1 mol·L-1的NH4HSO4溶液中,下列微粒的物质的量浓度关系不正确的是 ( )
| A.c(H+)>c(SO42-)>c(NH4+) |
| B.c(NH4+)+c(H+)=2c(SO42-)+c(OH-) |
| C.c(H+)=c(NH4+)+c(NH3·H2O)+c(OH-) |
| D.室温下滴加NaOH溶液至中性后:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,对于1 L 0.005 mol·L-1硫酸表述中正确的是( )
| A.由水电离出的c(H+)=1.0×10-12 mol·L-1 |
| B.加水稀释后,溶液中所有离子的浓度均减少 |
| C.2c(H+)=c(SO42-)+c(OH-) |
| D.滴加稀氨水使pH=7,则c(NH4+)=c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是 ( )
| A.0.1 mol·L-1的醋酸加水稀释,c(H+)/c(OH-)减小 |
| B.体积相同、pH相同的醋酸和盐酸完全溶解等量的镁粉,后者用时少 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 |
| D.V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com