
| A. | α粒子 | B. | 质子 | C. | 中子 | D. | ${\;}_{1}^{1}$ H |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 浓硫酸的还原产物是SO2 | |
| B. | 该装置可随时控制反应的发生或停止 | |
| C. | ①中有白色固体生成,加水后溶液呈蓝色 | |
| D. | ②中盛放Ba(NO3)2溶液可吸收SO2,防止空气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
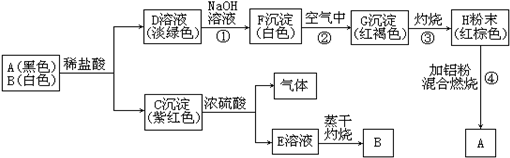
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023个碳原子的质量为1 g | |
| B. | 钠原子的摩尔质量为23 g | |
| C. | HCl的摩尔质量等于6.02×1023个HCl分子的质量 | |
| D. | Na2O2的摩尔质量为78 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
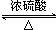 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.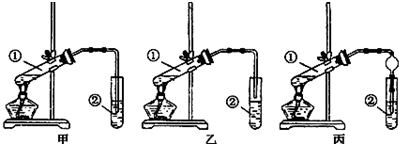
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 g D2O所含的电子数为10 NA | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1 NA | |
| C. | 1 mo1 Na被氧化成Na2O2,失去电子数目为2 NA | |
| D. | 氢气与氯气反应生成标准状况下22.4 L氯化氢,断裂化学键总数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com