
【题目】科学家模拟足贝类足丝蛋白的功能,合成了一种对云母、玻璃、二氧化硅等材料具有良好粘附性的物质一化合物I,其合成路线如下:

回答下列问题:
(1)A的化学名称为_____________________。
(2)由B生成C的化学方程式为_____________________________。
(3)由E和F反应生成D的反应类型为__________,由G和H反应生成I的反应类型为___________。
(4)D的结构筒式为____________,仅以D为单体合成高分子化合物的化学方程式为___________________。
(5)X是I的同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1。写出两种符合要求的X的结构简式_________________。
【答案】 丙烯  加成反应 取代反应
加成反应 取代反应 


【解析】试题分析:根据G的结构简式逆推,D是 ;C氧化为D,C是
;C氧化为D,C是![]() ;B水解为
;B水解为![]() ,则B是
,则B是![]() ;
;
解析:根据以上分析,(1)根据A的键线式,![]() 的分子式是C3H6,含有双键,所以化学名称为丙烯。
的分子式是C3H6,含有双键,所以化学名称为丙烯。
(2)![]() 在氢氧化钠溶液中水解为
在氢氧化钠溶液中水解为![]() ,B生成C的化学方程式为
,B生成C的化学方程式为 。
。
(3)由乙炔和甲酸反应生成 的反应类型为加成反应,
的反应类型为加成反应, ![]() 和
和![]() 反应生成
反应生成 属于取代反应。
属于取代反应。
(4)D的结构筒式为 , D含有碳碳双键,可以发生加聚反应,
, D含有碳碳双键,可以发生加聚反应,  通过加聚反应合成高分子化合物的化学方程式为
通过加聚反应合成高分子化合物的化学方程式为 。
。
(5)能发生银镜反应说明含有醛基,能与饱和碳酸氢钠溶液反应放出CO2,说明含有羧基,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1。符合以上要求的 的同分异构体的结构简式有
的同分异构体的结构简式有 。
。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组做以下属于对SO2的性质进行研究。请回答下列问题:

(1)装置B的作用是_______________________。
(2)装置C的目的是检验SO2的_____性。装置D中NaOH全部转化为NaHSO3的标志是_______________。
(3)请设计简单实验证明:室温下,NaHSO3溶液中HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小关系_______________________________。
(4)向装置D所得NaHSO3溶液中加入NaClO溶液时,反应有下列三种可能的情况:
Ⅰ.HSO3-与ClO-恰好反应 Ⅱ. NaClO不足 Ⅲ. NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 结论 |
① | 加入几小块CaCO3固体 | 有气泡产生 | Ⅰ或Ⅱ |
② | 滴加少量淀粉KI溶液,振荡 | __________ | Ⅲ |
③ | 滴加少量溴水,振荡 | _________ | Ⅱ |
④ | 滴加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | ______ |
(5)测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2 +2H2O==H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为_________g·L-1。
②在上述实验过程中,若有部分HI 被空气氧化,则测得结果________(填“偏高”、偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. PCl3的空间构型为平面三角形
B. HF、HCl、HBr、HI的熔沸点依次升高
C. 乳酸(![]() )有一对手性异构体,因为其分子中含有一个手性碳原子
)有一对手性异构体,因为其分子中含有一个手性碳原子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时。电池处于充电状态。混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极。碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理如图所示,其总反应式为H2+2NiOOH![]() 2Ni(OH)2以下说法正确的是
2Ni(OH)2以下说法正确的是

A. 混合动力车上坡或加速时,乙电极为负极
B. 混合动力车在刹车或下坡时,乙电极的电极反应式为Ni(OH)2+OH--e-==NiOOH+H2O
C. 混合动力车上坡或加速时,电解质溶液中的OH-向乙电极周围移动
D. 混合动力车上坡或加速时,乙电极周围溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2物质的量比为1:1,完成下列方程式:
____Mo+____HF+_____HNO3=_______MoO2F2+_______MoOF4+NO2↑+_____________,___________
(2)己知:
①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s)+2O2(g)==Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)==2MoO3(s)+4SO2(g) ΔH3
则ΔH3=_______(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2molMoS2参加反应,则转移电子_____mol。
(3)密闭容器中用Na2CO3(s)作固硫剂,同时用一定量的氢气还原钼矿(MoS2)原理是:MoS2(s)+4H2(g)+2Na2CO3(s)==Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH
实验测得平衡时的有关变化曲线如图所示

①由图可知,该反应的ΔH____0(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是_____(选填编号)。
A.V正(H2)=V逆(H2O)
B再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为_____(计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数KP=_____(MPa)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池。 磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
【方法一】 将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
【方法二】 将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其他产物均以气体逸出。
【方法三】 以铁红、锂辉石LiAl (SiO3)2 (含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如下:
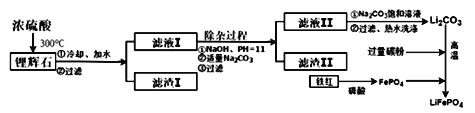
己知: 2LiAl (SiO3) 2+ H2SO4(浓)=Li2SO4+ Al2O3·4SiO2·H2O↓
溶解度/℃ | 20 | 40 | 60 | 80 |
溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
溶解度(Li2SO4) /g | 34.2 | 32.8 | 31.9 | 30.5 |
(1) 在方法一中,阳极生成磷酸亚铁锂的电极反应式为______________________________。
(2)在方法二中,除生成磷酸亚铁锂、乙酸外,还有H2O、________(填化学式)生成。
(3)方法一与方法二中,制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是________________。
(4)在方法三中从滤渣I中可分离出Al2O3,如下图所示。请写出生成沉淀的离子方程式________________。
![]()
(5)向滤液II中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是___________________________。(6) 写出在高温下生成磷酸亚铁锂的化学方程式______________________________________。
(7)磷酸铁锂锋动力电池(简称LFP) 是一种高效、超长寿命的二次电池。其工作原理为:
C6Li+FePO4![]() C6Li(1-x)+ (1-x) FePO4+xLiFePO4充电时,写出阴极反应方程式____________________。
C6Li(1-x)+ (1-x) FePO4+xLiFePO4充电时,写出阴极反应方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增大,B和C为同周期的金属元素,A和B的最外层电子数之和等于D元素原子的最外层电子数,A、B、C、D四种元素最高价氧化物对应的水化物分别为甲、乙、丙、丁,他们之间存在如图所示的反应关系(图中用“—“相连的两种物质间可发生反应),下列说法正确的是( )

A. 简单离子半径大小顺序:D>B>A>C
B. 等物质的量的BA3和B3A中含有的阴阳离子总数相等
C. 元素A和D的简单氢化物分子间仅存在范德华力
D. 元素B和D形成化合物的水溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵是一种重要化工产品,常温时,为白色晶体或粉末,易溶于水,难溶于CCl4,59℃时分解为氨及二氧化碳,其制备原理:2NH3(g)+CO2(g)![]() NH2COONH4(s)△H=-272kJ·mol-1。某化学兴趣小组利用下图实验装置(部分固定装置已省略)模拟制备NH2COONH4。试回答下列问题:
NH2COONH4(s)△H=-272kJ·mol-1。某化学兴趣小组利用下图实验装置(部分固定装置已省略)模拟制备NH2COONH4。试回答下列问题:

(1)仪器组装完毕后,首先应进行的操作是_____________________________。
(2)装置A用于实验室制取NH2COONH4的原料气体之一,该反应的化学方程式为_____________。
(3)装置F中试剂的名称为_________,装置G的作用为________________。
(4)为提高原料气的利用率,应控制装置C和E中最佳鼓泡速率比为____________,装置D采用冰水浴的原因为_____________________________________________________。
(5)生成的氨基甲酸铵悬浮于CCl4中,下列操作可实现产品分离的是_________。
![]()



(6)实验装置中存在明显不足之处的是______________,有同学认为装置H、G和F组成的装置过于复杂可简化,请简述该方法:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素在生物体内含量虽少,却是生命活动不可缺少的,可通过下面哪些实例得到证明( )
A. Mg2+是叶绿素的组成成分 B. 缺N会影响蛋白质的合成
C. 哺乳动物血液中Ca2+的含量太低会出现抽搐 D. 油菜缺少硼,会只开花不结果
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com