
| 物质 选项 | X | Y |
| A | Na2CO3 | NaHCO3 |
| B | Al(OH)3 | Al2O3 |
| C | FeCl3 | FeCl2 |
| D | CuSO4 | Cu(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碳酸钠和二氧化碳、水反应生成碳酸氢钠,碳酸氢钠加热分解生成碳酸钠;
B.加热氢氧化铝生成氧化铝,氧化铝与水不反应;
C.氯化铁和铁反应生成氯化亚铁,氯化亚铁和氯气反应生成氯化铁;
D.硫酸铜与氢氧化钠反应生成氢氧化铜,氢氧化铜与硫酸反应生成硫酸铜.
解答 解:A.Na2CO3+CO2+H2O=2NaHCO3、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,故A不选;
B.2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,氧化铝和水不反应,所以不能由氧化铝一步反应生成氢氧化铝,故B选;
C.2FeCl3+Fe=3FeCl2、2FeCl2+Cl2=2FeCl3,故C不选;
D.CuSO4+2NaOH=Cu(OH)2↓+Na2SO4、Cu(OH)2++H2SO4=CuSO4+2H2O,故D不选;
故选B.
点评 本题考查了物质间的转化,明确物质的性质是解本题关键,难度不大.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
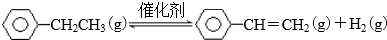
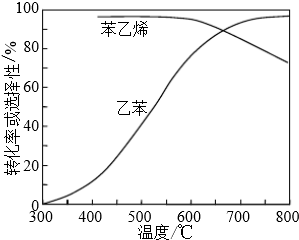
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- | |
| B. | Na2CO3溶液中CO32-的水解:CO32-+H2O=HCO3-+OH- | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(so3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反应在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 该温度下反应平衡常数为1.62×10-3L/mol | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 温度不变,向该容器中再充入0.2 mol SO2、0.1 mol O2,1.8 mol SO3反应达到新平衡时SO3转化率升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2H(g)+2X(g)═2HX(g)△H3<0 | |
| B. | △H1=△H2+△H3 | |
| C. | Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量按Cl、Br、I的顺序依次增多 | |
| D. | 途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)金刚石和石墨的晶胞如图,若碳原子半径为a cm 且相邻最近的碳原子相切,阿伏加德罗常数为NA,则金刚石的密度表达式为(要求整理为分母不含根号的表达式)$\frac{9\sqrt{3}}{1{6a}^{3}{N}_{A}}$g/cm3,一个石墨晶胞内含有4个碳原子,石墨的熔点比金刚石的熔点要高,其原因是石墨中碳碳键长小于金刚石中碳碳键长,这两种晶胞中碳的配位数(每个碳周围与之最近的碳原子数)之比为4:3.
(1)金刚石和石墨的晶胞如图,若碳原子半径为a cm 且相邻最近的碳原子相切,阿伏加德罗常数为NA,则金刚石的密度表达式为(要求整理为分母不含根号的表达式)$\frac{9\sqrt{3}}{1{6a}^{3}{N}_{A}}$g/cm3,一个石墨晶胞内含有4个碳原子,石墨的熔点比金刚石的熔点要高,其原因是石墨中碳碳键长小于金刚石中碳碳键长,这两种晶胞中碳的配位数(每个碳周围与之最近的碳原子数)之比为4:3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

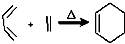 RCH2CH=CH2$→_{hv}^{Br_{2}}$RCHBrCH=CH2.请按要求回答下列问题:
RCH2CH=CH2$→_{hv}^{Br_{2}}$RCHBrCH=CH2.请按要求回答下列问题: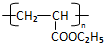 .
.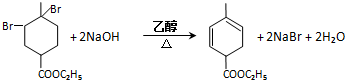 .
. 均2个,反应④的化学方程式为
均2个,反应④的化学方程式为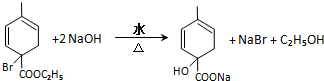 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在上述溶液中加入少量的NaOH或HCl溶液时,溶液的pH有可能不会发生显著变化 | |
| B. | 溶液中四种离子之间有可能满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 当溶液中溶质为CH3COONa和NaOH时,则一定有c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 当四种离子之间能满足c(CH3COO-)>c(Na+)>c(H+)>c(OH)时,则溶液中溶质一定是CH3COONa和CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com