
| A. | 0.1mol•L-1的(NH4)2Fe(SO4)2溶液中,c(Fe2+)+c(NH4+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 等体积等物质的量浓度的Na2CO3和NaHCO3溶液混合:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3c(Na+) | |
| C. | 0.2mol•L-1的CH3COOH溶液与0.1mol•L-1的NaOH溶液等体积混合:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) | |
| D. | PH相同的CH3COONa溶液、NaHCO3溶液、NaOH溶液:c(NaHCO3)>c(CH3COONa)>c(NaOH) |
分析 A.根据(NH4)2Fe(SO4)2溶液中的电荷守恒判断;
B.根据等体积等物质的量浓度的Na2CO3和NaHCO3混合液中的物料守恒判断;
C.反应后溶质为等浓度的醋酸和醋酸钠,根据混合液中的物料守恒和电荷守恒分析;
D.氢氧化钠为醛基,其浓度最小,醋酸的酸性大于碳酸,则碳酸氢钠的水解程度大于醋酸钠,pH相等时醋酸钠浓度较大、碳酸氢钠浓度较小;
解答 解:A.0.1mol•L-1的(NH4)2Fe(SO4)2溶液中,根据电荷守恒可知:2c(Fe2+)+c(NH4+)+c(H+)=2c(SO42-)+c(OH-),故A错误;
B.等体积等物质的量浓度的Na2CO3和NaHCO3溶液混合,溶质碳酸钠和碳酸氢钠的物质的量相等,根据物料守恒可得:3c(CO32-)+3c(HCO3-)+3c(H2CO3)=2c(Na+),故B错误;
C.0.2mol•L-1的CH3COOH溶液与0.1mol•L-1的NaOH溶液等体积混合,反应后溶质为等浓度的醋酸和醋酸钠,根据电荷守恒可得:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒可得:2c(Na+)=c(CH3COOH)+c(CH3COO-),二者结合可得:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),故C正确;
D.pH相同的CH3COONa溶液、NaHCO3溶液、NaOH溶液,NaOH为强电解质,其浓度最小;醋酸的酸性大于碳酸,则碳酸氢钠的水解程度大于醋酸钠,pH相等时,c(CH3COONa)>c(NaHCO3),所以三者浓度大小为:c(CH3COONa)>c(NaHCO3)>c(NaOH),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒、质子守恒及盐的水解原理在判断离子浓度大小中的应用方法.


科目:高中化学 来源: 题型:解答题
 某学生用如图所示装置证明溴和苯的反应是取代反应而不是加成反应,主要实验步骤如下:
某学生用如图所示装置证明溴和苯的反应是取代反应而不是加成反应,主要实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al还原性依次减弱 | |
| B. | F2、Cl2、Br2、I2单质的氧化性依次减弱 | |
| C. | C、N、O原子半径依次增大 | |
| D. | P、S、Cl最高正价依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,NA个CO2分子和NA个H2O分子的体积一定相同 | |
| B. | 含NA个Na+的Na2O溶解于1L水中Na+的物质的量浓度为1mol/L | |
| C. | 电解58.5g熔融的NaCl能产生22.4L氯气(标准状况)和23.0g金属钠 | |
| D. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子书为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分类回收、利用垃圾,减少资源浪费 | |
| B. | 推广使用一次性木筷,减少疾病传染 | |
| C. | 减少公车使用,从而减少化石燃料的使用 | |
| D. | 研究煤和石油脱硫技术,减少酸雨发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8个中子的碳原子的核素符号:12C | B. | 氢氧化钠的电子式: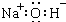 | ||
| C. | Cl-离子的结构示意图: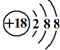 | D. | CH4分子的比例模型: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com