
| 实 验 内 容 | 实 验 目 的 | |
| A | 将SO2通入酸性KMnO4溶液中 | 证明SO2的水溶液具有弱酸性 |
| B | 将饱和的FeCl3溶液滴到沸水中 | 促进Fe3+水解,制得Fe(OH)3胶体 |
| C | 在淀粉KI溶液中滴加少量市售食盐配制的溶液 | 真假碘盐的鉴别 |
| D | 在少量Fe(NO3)2试样加水溶解的溶液中,滴加稀H2SO4酸化,再滴加KSCN溶液 | 检验Fe(NO3)2试样是否变质 |
| A、A | B、B | C、C | D、D |


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
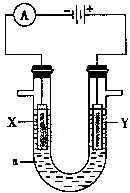 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )| A、a点表示溶液中c(CH3COO-)约为10-3 mol/L | ||
| B、b点表示的溶液中c(Na+)>c(CH3COO-) | ||
| C、c点表示CH3COOH和NaOH恰好反应完全 | ||
D、d点表示的溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 某条件下在密闭容器中发生反应X2+3Y2?2Z2,右图是反应过程中,反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
某条件下在密闭容器中发生反应X2+3Y2?2Z2,右图是反应过程中,反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A、0~t1时,X2、Y2、Z2的物质的量浓度由于反应进行而减小 |
| B、t2~t3时,反应体系中Y2的浓度没有变化 |
| C、到t3以后,反应已达限度,不管如何改变条件,反应不再进行 |
| D、从关系曲线可知,反应开始时体系中只有X2和Y2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将铜屑加入Fe3+溶液中:2Fe3++Cu=2Fe2++Cu2+ |
| B、用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| C、醋酸钠的水解:CH3COO-+H3O+?CH3COOH+H2O |
D、苯酚钠溶液中通入CO2气体: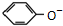 +CO2+H2O→ +CO2+H2O→ +HCO3- +HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀HCl溶液 |
| B、稀Na2SO4溶液 |
| C、CuCl2溶液 |
| D、酸性AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 气体总浓度(mol/L) 温度(℃) 时间(min) |
15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 0.9×10-3 | 2.7×10-3 | 8.1×10-3 |
| t2 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
| t3 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com