
����Ŀ�������£���0.01 molNH4Cl��0.005mol NaOH����ˮ���1 L ��Һ��Ph>7��.
(1)����Һ�д��ڵ�����ƽ����ϵ�ǣ� __ _____��__ ____��_____________��
(2)��Һ�д��ڵ��������ʵ���Ũ���ɴ�С˳��Ϊ ��
(3)��Щ������Ũ��Ϊ0.01 mol/L ����_________��Ũ��Ϊ0.005 mol/L ����_________��
(4)���ʵ���֮��Ϊ0.01 mol�����������ǣ�_________________________��
(5)NH4+��H+������������֮�ͱ�OH����_______mol��
���𰸡���1��NH3��H2O![]() NH4����OH����NH4����H2O
NH4����OH����NH4����H2O![]() NH3��H2O��H����H2O
NH3��H2O��H����H2O![]() H����OH����
H����OH����
��2��c��Cl����>c��NH4����>c��Na����>c��OH����>c��H��������3��Cl����Na����
��4��NH4����NH3��H2O����5��0.005��
��������
�����������1��NH4Cl��NaOH=NH3��H2O��NaCl������������Ӧ����Һ����ΪNH3��H2O��NaCl��NH4Cl����˴���ƽ����ϵ����NH3��H2O![]() NH4����OH����NH4����H2O
NH4����OH����NH4����H2O![]() NH3��H2O��H������Һ����ˮ��ˮ��������������ڵ���ƽ������H2O
NH3��H2O��H������Һ����ˮ��ˮ��������������ڵ���ƽ������H2O![]() H����OH������2����Ӧ�����ߵ����ʵ�����ȣ�NH3��H2O�ĵ���̶ȴ���NH4����ˮ��̶ȣ���Һ�Լ��ԣ���ˮ�ĵ���̶������������Ũ�ȴ�С��c��Cl���� > c�� NH4 �� �� > c��Na �� �� > c��OH���� > c��H �� ������3��Cl����ˮ�⣬���c(Cl��) = 0.01mol��L��1��Na �� ��ˮ�⣬���c(Na �� ) = 0.005mol��L��1��(4)���������غ㣬�����c(NH4 �� ) �� c(NH3��H2O) = 0.01mol��L��1��(5)���ݵ���غ㣬c(Na �� ) �� c(H �� ) �� c(NH4 �� ) = c(OH��) �� c(Cl��)��c(H �� ) �� c(NH4 �� )��c(OH��) = c(Cl��)��c(Na �� ) = 0.005mol��L��1��
H����OH������2����Ӧ�����ߵ����ʵ�����ȣ�NH3��H2O�ĵ���̶ȴ���NH4����ˮ��̶ȣ���Һ�Լ��ԣ���ˮ�ĵ���̶������������Ũ�ȴ�С��c��Cl���� > c�� NH4 �� �� > c��Na �� �� > c��OH���� > c��H �� ������3��Cl����ˮ�⣬���c(Cl��) = 0.01mol��L��1��Na �� ��ˮ�⣬���c(Na �� ) = 0.005mol��L��1��(4)���������غ㣬�����c(NH4 �� ) �� c(NH3��H2O) = 0.01mol��L��1��(5)���ݵ���غ㣬c(Na �� ) �� c(H �� ) �� c(NH4 �� ) = c(OH��) �� c(Cl��)��c(H �� ) �� c(NH4 �� )��c(OH��) = c(Cl��)��c(Na �� ) = 0.005mol��L��1��


 ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����pH=1������ƽ���ֳ����ݣ�һ�ݼ�����ˮ����һ�ݼ�������������ʵ���Ũ����ͬ������NaOH��Һ��pH��������1��������ˮ��NaOH��Һ�������Ϊ�� ��
A��11��1 B��12��1 C��9 ��1 D��10��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������CO2ͨ��NaOH��BaOH2�Ļ��ϡ��Һ�У����ɳ��������ʵ���(n)��ͨ��CO2��������(V)�Ĺ�ϵ��ͼ��ʾ��ͼ��AB�α�ʾ�����ӷ���ʽ�Ⱥ�˳����ȷ����
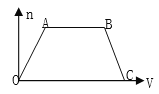
��CO2+OH����HCO3��
��CO2+2OH����CO32��+H2O
��CO32��+Ba2+��BaCO3��
��BaCO3+CO2+H2O��Ba2++2HCO3��
��CO32��+CO2+H2O��2HCO3��
A. �ۢ� B. �ܢ� C. �ݢ� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�ͭ����Դ�ֲ��㷺����̽���������������λ��ͭԪ�س�����̬Ϊ+1��+2�������+1��ͭ�Ļ�������������磺CuCl��Cu2O�ȡ�+1��ͭ������������������Ӧ��2Cu+= Cu2++ Cu��
��1��CuClͨ������������ɱ������ýȾ������ɫ����ijʵ����ȤС��ģ���Ʊ�CuCl��
����һ����CuCl2��Һ����μ���KI��Һ���ܷ�����2Cu2++2Cl��+2I��=2CuCl��(��ɫ)+I2��Ϊ˳���۲쵽��ɫ�������Լ��������Լ���_____________��
A��SO2 B���� C��NaOH��Һ D���Ҵ�
����������Na2SO3��Һ��μ���CuCl2��Һ���ټ���������Ũ������ȣ������Һ�����˳���������������ˮ�Ҵ����ϴ�ӣ��ð�ɫ��ĩ״���塣
�ٳ����Ĺ��˺�ϴ�Ӿ��õ��IJ���������_____________________��
��ϴ��CuCl�����IJ���Ϊ_________________________��
��2������Cu2O��������Ĺ�ѧ����ѧ����绯ѧ���ʣ��о��Ʊ�����������ͭ�ķ�����Ϊ��ǰ���о��ȵ�֮һ��
����һ��������Cu(OH)2��Һ�е���N2H4H2Oˮ��Һ����ɫ������ת��Ϊש��ɫ��ͬʱ������ɫ��ζ�����塣д�������Ʊ������еĻ�ѧ��Ӧ����ʽ____________________��
����������ͭ��������ʯī����������⺬��NaOH��NaClˮ��Һ��
��֪���õ�����������������������CuCl������NaOH��Ӧת��ΪCu2O��
��д�������ĵ缫��Ӧʽ__________________________��
�ڵ�����Һ��c(OH��)��___________����������С�����䡱����
��������·��ͨ��0.2 mol���ӣ�����������Cu2O������Ϊ________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤±�ص��������Ե���Խ�����ijС������ͼװ�ý���ʵ�飨�г���������ȥ���������Ѽ��飩��ʵ����̣�
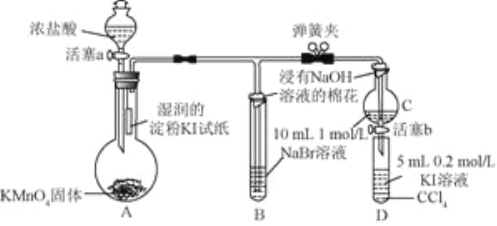
�������ɼУ�����a���μ�Ũ���ᣬA�в�������ɫ���塣
������B��C�е���Һ����Ϊ��ɫʱ���н����ɼС�
������B����Һ�ɻ�ɫ��Ϊ�غ�ɫʱ���رջ���a��
��������
��1��D�����Ȼ�̼�ĵ���ʽ�� ��
��2����֤������������ǿ�ڵ��ʵ�������� ��
��3��B����Һ������Ӧ�����ӷ���ʽ�� ��
��4��Ϊ��֤���������ǿ�ڵ⣬�������������������� ��
��5��������ʵ���Ŀ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ᷴӦ����������������Һ��Ӧ�Ļ�������
A. SiO2 B. Al2O3 C. Na2CO3 D. AlCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ͼʾװ���Ʊ�KClO��Һ������KOH��Fe(NO3)3��Һ��Ӧ�Ʊ���Ч��ˮ��K2FeO4��
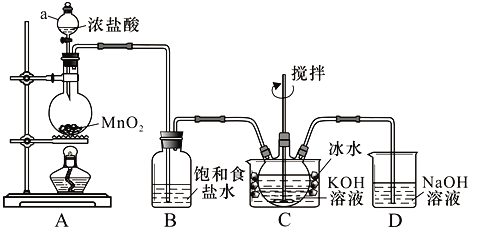
<��������>Cl2��KOH��Һ��20�����·�Ӧ����KClO���ڽϸ��¶���������KClO3��
K2FeO4������ˮ������ŨKOH��Һ����0����5����ǿ������Һ�н��ȶ���
��1������a�����ƣ� ��װ��C������ƿ���ڱ�ˮԡ�е�Ŀ���� ��
��2��װ��B���յ������� ��װ��D�������� ��
��3��C�еõ�����KClO������ƿ�ϵĵ���ȡ�£����μ���KOH��Һ��Fe(NO3)3��Һ��ˮԡ���Ʒ�Ӧ�¶�Ϊ25��������1.5 h����Һ��Ϊ�Ϻ�ɫ(��K2FeO4)���÷�Ӧ�����ӷ���ʽΪ ���ټ��뱥��KOH��Һ�������Ϻ�ɫ���壬���ˣ��õ�K2FeO4�ֲ�Ʒ��
��4��K2FeO4�ֲ�Ʒ����Fe(OH)3��KCl�����ʣ����ᴿ����Ϊ��
����һ������K2FeO4�ֲ�Ʒ�������3 mol/L KOH��Һ�С�
�����ˡ�
�� ��
�����衢���á����ˣ����Ҵ�ϴ��2��3�Ρ�
������ո������и��
��5����ȡ�ᴿ���K2FeO4��Ʒ0.2200 g���ձ��У�����ǿ�����Ǹ�������Һ����Ӧ���ټ�ϡ���������Һ��ǿ���������250 mL��Һ��ȡ��25.00 mL������ƿ����0.01000 mol/L��(NH4)2Fe(SO4)2��Һ�ζ����յ㣬�ظ�����2����ƽ������(NH4)2Fe(SO4)2��Һ30.00 mL���漰��Ҫ��ӦΪ��
Cr(OH)4����FeO42�� �� Fe(OH)3����CrO42����OH��
2CrO42����2H+![]() Cr2O72����H2O
Cr2O72����H2O
Cr2O72����6Fe2+��14H+ �� 6Fe3+��2Cr3+��7H2O
���K2FeO4��Ʒ�Ĵ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.1mol/L K2CO3��Һ�У���ʹc (CO32��)���ӽ�0.1 mol/L���ɲ�ȡ�Ĵ�ʩ�ǣ� ��
A. ��KOH���� B����ˮ C�������������� D������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com