
| A. | Na+、K+、Fe2+、Cl- | B. | K+、Fe3+、NO3-、Fe(OH)3(胶体) | ||
| C. | Cl-、SCN-、NH4+、葡萄糖分子 | D. | OH-、Na+、苯酚、Br - |
分析 无色溶液中不存在有色的离子,如:Cu2+、Fe2+、Fe3+、MnO4-等,加入FeCl3后溶液显色,说明溶液中存在硫氰根离子或苯酚,
A.亚铁离子为有色离子,且加入氯化铁后溶液不显色;
B.铁离子有色,氢氧化铁胶体能够发生丁达尔现象,且氢氧化铁胶体能够与阴离子发生聚沉现象;
C.四种粒子都是无色的,且不具有丁达尔现象、加入氯化铁后能够显示红色;
D.苯酚与氢氧根离子反应.
解答 解:无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,加入FeCl3后溶液显色,说明溶液中存在SCN-或苯酚,
A.Fe2+为有色离子,不满足溶液无色的条件,且加入氯化铁后溶液不显色,故A错误;
B.Fe3+为有色离子,NO3-、Fe(OH)3(胶体)发生聚沉现象,Fe(OH)3(胶体)具有丁达尔现象,故B错误;
C.Cl-、SCN-、NH4+、葡萄糖分子都是无色粒子,都不具有丁达尔现象,加入FeCl3后生成硫氰化铁,溶液显示红色,故C正确;
D.苯酚又名石碳酸,能够与OH-反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查粒子共存的正误判断,题目难度中等,涉及离子的性质、胶体性质、离子共存等知识,明确离子反应发生条件及题干信息的含义为解答关键,试题侧重考查学生的分析能力及灵活应用基础知识的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
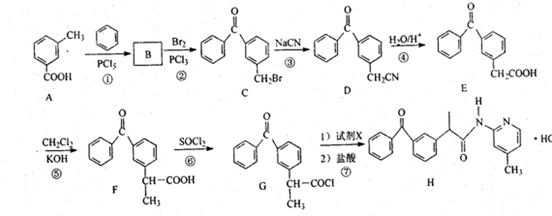
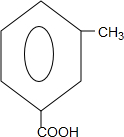 +
+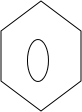 $\stackrel{PCl_{3}}{→}$
$\stackrel{PCl_{3}}{→}$ +H2O.
+H2O.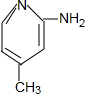 .
.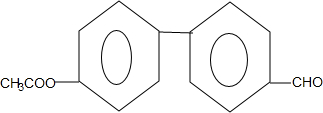 (只写一种).
(只写一种).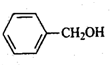 和
和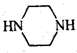 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AD盐溶液pH>7 | B. | .酸的电离程度一定是HD<HC | ||
| C. | .碱的电离程度一定是AOH>BOH | D. | .在AC盐溶液中c(A+)+c(AOH)=c(C-)+c(HC) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测量等浓度的Na2CO3与C6H5ONa溶液的pH | Na2CO3溶液的pH大于C6H5ONa的pH | H2CO3的酸性大于C6H5OH |
| B | 将SO2通入溴水中 | 溴水褪色 | SO2具有漂白性 |
| C | 取少量的变质FeCl2晶体于试管中,逐滴加入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | FeCl2未完全变质 |
| D | 向苯酚的苯溶液中加入足量NaOH溶液,振荡静置 | 分层 | 上层为苯,下层为NaOH与苯酚钠的混合溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用催化措施,将汽车尾气中的CO和NO转化为无害气体 | |
| B. | 合金材料中不可能含有非金属元素 | |
| C. | 信息产业中的光缆的主要成分是单质硅 | |
| D. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$
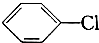 :
: +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$ +HCl.
+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下22.4L HF含有的分子数约为NA | |
| B. | 常温下,1L、pH=13的氨水中OH-的数目为0.1NA | |
| C. | 1mol铁与足量硫的完全反应,失去的电子数为3NA | |
| D. | 同温、同压、同体积的氢气和臭氧具有相同的分子数和原子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com