
ЁОЬтФПЁПЦћГЕАВШЋЦјФвжаЬюГфЕўЕЊЫсФЦ![]() КЭЯѕЫсМи
КЭЯѕЫсМи![]() ЁЃЦћГЕЗЂЩњУЭСвзВЛїЪБЃЌ
ЁЃЦћГЕЗЂЩњУЭСвзВЛїЪБЃЌ![]() ЛсбИЫйЗжНтВњЩњ
ЛсбИЫйЗжНтВњЩњ![]() КЭNaЃЌNaЕЅжЪПЩгы
КЭNaЃЌNaЕЅжЪПЩгы![]() МЬајЗДгІЁЃЭъГЩЯТСаЬюПеЃК
МЬајЗДгІЁЃЭъГЩЯТСаЬюПеЃК
![]() дзгзюЭтВуЕчзгЕФЕчзгХХВМЪНЮЊ______ЃЌЕЊЦјЕФЕчзгЪНЮЊ______ЁЃ
дзгзюЭтВуЕчзгЕФЕчзгХХВМЪНЮЊ______ЃЌЕЊЦјЕФЕчзгЪНЮЊ______ЁЃ
![]() ЧыНЋ
ЧыНЋ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() АДееРызгАыОЖгЩДѓЕНаЁЕФЫГађХХСа______
АДееРызгАыОЖгЩДѓЕНаЁЕФЫГађХХСа______![]() ЬюРызгЗћКХ
ЬюРызгЗћКХ![]() ЁЃ
ЁЃ
![]() ЕФН№ЪєадЧПгкNaЃЌгУвЛИіЪТЪЕЫЕУї______ЁЃ
ЕФН№ЪєадЧПгкNaЃЌгУвЛИіЪТЪЕЫЕУї______ЁЃ
![]() ХфЦНNaгы
ХфЦНNaгы![]() ЗДгІЕФЛЏбЇЗНГЬЪНЃЌВЂБъГіЕчзгзЊвЦЕФЗНЯђгыЪ§ФПЃК
ЗДгІЕФЛЏбЇЗНГЬЪНЃЌВЂБъГіЕчзгзЊвЦЕФЗНЯђгыЪ§ФПЃК
______![]() ______
______![]() ______
______![]() ______
______![]() ЃЌШєБъзМзДПіЯТЩњГЩ
ЃЌШєБъзМзДПіЯТЩњГЩ![]() ЕЊЦјЃЌзЊвЦЕФЕчзгЪ§ФПЮЊ______
ЕЊЦјЃЌзЊвЦЕФЕчзгЪ§ФПЮЊ______![]() ЁЃ
ЁЃ
![]() ЧыНтЪЭ
ЧыНтЪЭ![]() ОЇЬхБШ
ОЇЬхБШ![]() ОЇЬхШлЕуЕЭЕФдвђ______ЁЃ
ОЇЬхШлЕуЕЭЕФдвђ______ЁЃ
ЁОД№АИЁП![]()
![]()
![]() KOHЕФМюадБШNaOHЕФМюадЧП 10 2 5 1
KOHЕФМюадБШNaOHЕФМюадЧП 10 2 5 1 ![]()
![]() ЁЂ
ЁЂ![]() ОЇЬхОљЮЊРызгОЇЬхЃЌвѕРызгЯрЭЌЃЌ
ОЇЬхОљЮЊРызгОЇЬхЃЌвѕРызгЯрЭЌЃЌ![]() БШ
БШ![]() АыОЖДѓЁЂЧвЫљДјЕчКЩЯрЭЌЃЌЫљвд
АыОЖДѓЁЂЧвЫљДјЕчКЩЯрЭЌЃЌЫљвд![]() жаРызгМќБШ
жаРызгМќБШ![]() жаРызгМќШѕЃЌ
жаРызгМќШѕЃЌ![]() ОЇЬхБШ
ОЇЬхБШ![]() ОЇЬхШлЕуЕЭ
ОЇЬхШлЕуЕЭ
ЁОНтЮіЁП
ЃЈ1ЃЉNдЊЫиЪЧ7КХдЊЫиЃЌзюЭтВуЕчзгЪ§ЮЊ5ЃЌХХВМдк2sЁЂ2pЙьЕРЩЯЃЌNдзгзюЭтВуЕчзгЕФЕчзгХХВМЪНЮЊ2s22p3ЃЌЕЊЦјЗжзгжаКЌга![]() МќЃЌМДКЌга3ЖдЙВгУЕчзгЖдЃЌВЂЧвNдзгОљДяЕН8eЃНсЙЙЃЌЕЊЦјЕчзгЪНЮЊ
МќЃЌМДКЌга3ЖдЙВгУЕчзгЖдЃЌВЂЧвNдзгОљДяЕН8eЃНсЙЙЃЌЕЊЦјЕчзгЪНЮЊ![]() ЃЛ
ЃЛ
ЃЈ2ЃЉNaЃЋЃЋЁЂO2ЃЁЂN3ЃКЫЭтОљга10ИіЕчзгЃЌМДКЫЭтЕчзгХХВМЯрЭЌЃЌРызгЕФКЫЭтЕчзгХХВМЯрЭЌЪБЃЌдзгађЪ§дНДѓЃЌЦфРызгАыОЖдНаЁЃЌШ§жжЮЂСЃЕФРызгАыОЖгЩДѓаЁЫГађЮЊN3Ѓ>O2Ѓ>NaЃЋЃЛ
ЃЈ3ЃЉKЁЂNaОљЮЊЛюЦУН№ЪєЃЌПЩЭЈЙ§БШНЯKOHЁЂNaOHЕФМюадЧПШѕХаЖЯЖўепН№ЪєадЃЌвђЮЊKOHЕФМюадДѓгкNaOHЃЌЫљвдKЕФН№ЪєадЧПЃЛ
ЃЈ4ЃЉЗНГЬЪНжаNaЕФЛЏКЯМлЩ§Ип1ЃЌNЕФЛЏКЯМлНЕЕЭ5ЃЌЕЋЩњГЩЮяжаОљКЌга2ИідзгЃЌЫљвдзЊвЦЕчзгЮЊ10ИіЃЌМДNaЮЊ10ЃЌ![]() ЮЊ1ЃЌдйИљОндзгЪиКуЕУЕНЛЏбЇЗНГЬЪНЮЊ
ЮЊ1ЃЌдйИљОндзгЪиКуЕУЕНЛЏбЇЗНГЬЪНЮЊ![]() ЃЌгУЕЅЯпЧХЗЈБэЪОЕчзгзЊвЦЮЊ
ЃЌгУЕЅЯпЧХЗЈБэЪОЕчзгзЊвЦЮЊ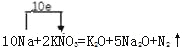 ЃЌгЩЛЏбЇЗНГЬЪНПЩжЊЃЌУПЩњГЩ
ЃЌгЩЛЏбЇЗНГЬЪНПЩжЊЃЌУПЩњГЩ![]() зЊвЦ10molЕчзгЃЌдђЩњГЩ
зЊвЦ10molЕчзгЃЌдђЩњГЩ![]() МД
МД![]() ЪБЃЌзЊвЦЕчзг
ЪБЃЌзЊвЦЕчзг![]() зЊвЦЕчзгЪ§ЮЊ
зЊвЦЕчзгЪ§ЮЊ![]() ЃЛ
ЃЛ
ЃЈ5ЃЉK2OЁЂNa2OОЇЬхОљЮЊРызгОЇЬхЃЌвѕРызгЯрЭЌЃЌ![]() БШ
БШ![]() АыОЖДѓЁЂЧвЫљДјЕчКЩЯрЭЌЃЌ
АыОЖДѓЁЂЧвЫљДјЕчКЩЯрЭЌЃЌ![]() жаРызгМќБШ
жаРызгМќБШ![]() жаРызгМќШѕЃЌ
жаРызгМќШѕЃЌ![]() ЕФОЇИёФмБШ
ЕФОЇИёФмБШ![]() ЕФаЁЃЌЫљвд
ЕФаЁЃЌЫљвд![]() ЕФШлЕуБШ
ЕФШлЕуБШ![]() ЕФЕЭЃЛ
ЕФЕЭЃЛ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЮТЖШЪБЃЌдк2 LЕФУмБеШнЦїжаЃЌXЁЂYЁЂZЃЈОљЮЊЦјЬхЃЉШ§жжЮяжЪЕФСПЫцЪБМфЕФБфЛЏЧњЯпШчЭМЫљЪОЁЃ

ЃЈ1ЃЉгЩЭМжаЫљИјЪ§ОнНјааЗжЮіЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ ЃЛ
ЃЈ2ЃЉЗДгІДгПЊЪМжС2ЗжжгЃЌгУZЕФХЈЖШБфЛЏ БэЪОЕФЦНОљЗДгІЫйТЪЮЊv(Z)= ЃЛ
ЃЈ3ЃЉ2minЗДгІДяЦНКтШнЦїФкЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПБШЦ№ЪМЪБ ЃЈЬюдіДѓЁЂМѕаЁЛђВЛБфЃЉЃЛЛьКЯЦјЬхУмЖШБШЦ№ЪМЪБ ЃЈЬюдіДѓЁЂМѕаЁЛђВЛБфЃЉЁЃ
ЃЈ4ЃЉНЋa mol Xгыb mol YЕФЛьКЯЦјЬхЗЂЩњЩЯЪіЗДгІЃЌЗДгІЕНФГЪБПЬИїЮяжЪЕФСПЧЁКУТњзуЃКn (X) = n (Y) = n (Z)ЃЌдђдЛьКЯЦјЬхжаa : b = ЁЃ
ЃЈ5ЃЉЯТСаДыЪЉФмМгПьЗДгІЫйТЪЕФЪЧ ЁЃ
AЃЎКубЙЪБГфШыHe
BЃЎКуШнЪБГфШыHe
CЃЎКуШнЪБГфШыX
DЃЎМАЪБЗжРыГіZ
EЃЎЩ§ИпЮТЖШ
FЃЎбЁдёИпаЇЕФДпЛЏМС
ЃЈ6ЃЉЯТСаЫЕЗЈе§ШЗЕФЪЧ ЁЃ
AЃЎЩ§ИпЮТЖШИФБфЛЏбЇЗДгІЕФЯоЖШ
BЃЎвбжЊе§ЗДгІЪЧЮќШШЗДгІЃЌЩ§ИпЮТЖШЦНКтЯђгввЦЖЏЃЌе§ЗДгІЫйТЪМгПьЃЌФцЗДгІЫйТЪМѕТ§
CЃЎЛЏбЇЗДгІЕФЯоЖШгыЪБМфГЄЖЬЮоЙи DЃЎЛЏбЇЗДгІЕФЯоЖШЪЧВЛПЩФмИФБфЕФ
EЃЎ діДѓYЕФХЈЖШЃЌе§ЗДгІЫйТЪМгПьЃЌФцЗДгІЫйТЪМѕТ§
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗДгІФмгУ![]() РДБэЪОЕФЪЧ
РДБэЪОЕФЪЧ![]() ЁЁЁЁ
ЁЁЁЁ![]()
A. ГЮЧхЪЏЛвЫЎгы![]() ШмвКЗДгІ B.
ШмвКЗДгІ B. ![]() КЭ
КЭ![]() ШмвКЗДгІ
ШмвКЗДгІ
C. NaOHШмвККЭ![]() ШмвКЗДгІ D.
ШмвКЗДгІ D. ![]() ШмвККЭHIШмвКЗДгІ
ШмвККЭHIШмвКЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаЙиБЅКЭСДЬўЕФа№ЪіЃЌДэЮѓЕФЪЧ![]() ЁЁЁЁ
ЁЁЁЁ![]()
A. ЖМЪЧПЩШМЮя B. ЬиеїЗДгІЪЧШЁДњЗДгІ
C. ЫцЬМдзгИіЪ§діМгЃЌЗаЕувРДЮЩ§Ип D. ЫцЧтдзгИіЪ§діМгЃЌКЌЧтСПЩ§Ип
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП80 ЁцЪБЃЌ2 LУмБеШнЦїжаГфШы0.40 mol N2O4ЃЌЗЂЩњЗДгІN2O4(g)![]() 2NO2(g)ЁЁІЄHЃНЃЋ53 kJ/molЃЌЛёЕУШчЯТЪ§ОнЁЃЯТСаХаЖЯе§ШЗЕФЪЧ
2NO2(g)ЁЁІЄHЃНЃЋ53 kJ/molЃЌЛёЕУШчЯТЪ§ОнЁЃЯТСаХаЖЯе§ШЗЕФЪЧ
ЪБМф/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/molЁЄLЃ1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
A. Щ§ИпЮТЖШИУЗДгІЕФЦНКтГЃЪ§KМѕаЁ
B. ИУЗДгІЕФ ІЄS <0
C. ЗДгІДяЦНКтЪБЮќШШ15.9 kJ
D. 100 sЪБдйЭЈШы0.40 mol N2O4ЃЌДяаТЦНКтЪБN2O4ЕФЬхЛ§ЗжЪ§МѕаЁ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЛЏбЇаЫШЄаЁзщЩшМЦСЫШчЭМЫљЪОзАжУЬНОПАБЕФЛЙдадЃЌAЮЊАБЦјЕФжЦБИзАжУЁЃЭъГЩЯТСаЬюПеЃК

![]() жаЭЈЙ§МгШШ
жаЭЈЙ§МгШШ![]() ЙЬЬхРДжЦБИАБЦјЃЌГ§ЬњМмЬЈ
ЙЬЬхРДжЦБИАБЦјЃЌГ§ЬњМмЬЈ![]() КЌЬњМа
КЌЬњМа![]() КЭОЦОЋЕЦЭтЛЙашгУЕНЕФЪЧ______
КЭОЦОЋЕЦЭтЛЙашгУЕНЕФЪЧ______![]() бЁЬюЯТСавЧЦїБрКХ
бЁЬюЯТСавЧЦїБрКХ![]() ЁЃ
ЁЃ

![]() ВЙГфЭъећКѓЃЌгаЭЌбЇШЯЮЊзАжУдкАВШЋадЩЯЛЙДцдкШБЯнЃЌашвЊдк______
ВЙГфЭъећКѓЃЌгаЭЌбЇШЯЮЊзАжУдкАВШЋадЩЯЛЙДцдкШБЯнЃЌашвЊдк______![]() ЬюађКХ
ЬюађКХ![]() СЌНгЭМЫљЪОзАжУЁЃ
СЌНгЭМЫљЪОзАжУЁЃ
![]() жЎМф
жЎМф
![]() жЎМф
жЎМф
![]() жЎМф
жЎМф
![]() жЎКѓ
жЎКѓ

АДееИФНјКѓЕФзАжУНјааЪЕбщЃЌМьбщЦјУмадКѓЃЌЯШНЋCДІЕФВЌЫПМгШШЕНКьШШЃЌдйНЋAДІЦјЬхЭЈЙ§BзАжУЦЌПЬКѓЃЌГЗШЅCДІОЦОЋЕЦМЬајЗДгІЃЌПЩЙлВьЕНЕФВПЗжЯжЯѓЮЊЃКВЌЫПБЃГжКьШШЃЌDжаШмвКБфКьЁЃ
![]() жаЫљЕУЛьКЯЦјЬхЭЈЙ§BКѓЛсВњЩњ
жаЫљЕУЛьКЯЦјЬхЭЈЙ§BКѓЛсВњЩњ![]() ЃЌBжаЗДгІЕФЛЙдМСЪЧ______ЁЃ
ЃЌBжаЗДгІЕФЛЙдМСЪЧ______ЁЃ
![]() аДГіCжа
аДГіCжа![]() гы
гы![]() ЗДгІЕФЛЏбЇЗНГЬЪН______ЃЌПЩгУгкХаЖЯИУЗДгІЪЧЗХШШЛЙЪЧЮќШШЕФЪЕбщЯжЯѓЪЧ______ЁЃ
ЗДгІЕФЛЏбЇЗНГЬЪН______ЃЌПЩгУгкХаЖЯИУЗДгІЪЧЗХШШЛЙЪЧЮќШШЕФЪЕбщЯжЯѓЪЧ______ЁЃ
![]() ЪЙDжаЪЏШяШмвКБфКьЕФЮяжЪЪЧ______
ЪЙDжаЪЏШяШмвКБфКьЕФЮяжЪЪЧ______![]() ЬюаДЛЏбЇЪН
ЬюаДЛЏбЇЪН![]() ЁЃ
ЁЃ
![]() гаЭЌбЇШЯЮЊЃЌDжаШмвКФкПЩФмКЌга
гаЭЌбЇШЯЮЊЃЌDжаШмвКФкПЩФмКЌга![]() ЃЌШчКЮМьбщ______ЁЃ
ЃЌШчКЮМьбщ______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЬМЫсУЬ(MnCO3)ЪЧжЦдьЕчаХЦїВФЕФШэДХЬњбѕЬхЃЌвВгУзїЭбСђЕФДпЛЏМСЃЌДЩгдЁЂЭПСЯКЭЧхЦсЕФбеСЯЁЃЙЄвЕЩЯРћгУШэУЬПѓ(жївЊГЩЗжЪЧMnO2ЃЌЛЙКЌгаFe2O3ЁЂCaCO3ЁЂCuOЕШдгжЪ)жЦШЁЬМЫсУЬЕФСїГЬШчЯТЭМЫљЪОЃК

вбжЊЃКЛЙдБКЩежїЗДгІЮЊ2MnO2+C![]() 2MnO+CO2ЁќЁЃ
2MnO+CO2ЁќЁЃ
ПЩФмгУЕНЕФЪ§ОнШчЯТЃК

ИљОнвЊЧѓЛиД№ЯТСаЮЪЬт
(1)дкЪЕбщЪвНјааВНжшAВйзїЃЌашвЊгУЕНЕФвЧЦїУћГЦЮЊ___________ЁЃ
(2)ВНжшCжаЕУЕНЕФТЫдќжївЊГЩЗжЪЧCaSO4КЭ___________ЃЌВНжшDжаЛЙдМСгыбѕЛЏМСЕФЮяжЪЕФСПжЎБШЮЊ___________ЁЃ
(3)ВНжшEжаЕїНкpHЕФЗЖЮЇЮЊ___________ЃЌЦфФПЕФЪЧ______________________ЁЃ
(4)ВНжшGЗЂЩњЕФРызгЗНГЬЪНЮЊ_________________________________ЃЌШєMn2+ГСЕэЭъШЋЪБВтЕУШмвКжаCO32ЃЕФХЈЖШЮЊ2.2ЁС10Ѓ6mol/LЃЌдђKsp(MnCO3)=___________ЁЃ
(5)ЪЕбщЪвПЩвдгУNa2S2O8ШмвКРДМьбщMn2+ЪЧЗёЭъШЋЗЂЩњЗДгІЃЌдРэЮЊMn2++S2O82Ѓ+H2OЁњH++SO42Ѓ+MnO4ЃЃЌШЗШЯMn2+РызгвбОЭъШЋЗДгІЕФЯжЯѓЪЧ___________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊдквЛЖЈЮТЖШЯТЃЌвЛЖЈЬхЛ§ЕФУмБеШнЦїРяДцдкШчЯТЦНКтЃК2SO2(g)ЃЋO2(g)![]() 2SO3(g)ЃЌШєПЊЪМЪБГфШы2 mol SO3ЃЌДяЕНЦНКтЪБЛьКЯЦјЬхЕФбЙЧПБШЦ№ЪМЪБдіДѓСЫ10%ЃЛШєПЊЪМЪБГфШы2 mol SO2КЭ1 mol O2ЃЌдђДяЕНЦНКтЪБSO2ЕФзЊЛЏТЪЮЊ
2SO3(g)ЃЌШєПЊЪМЪБГфШы2 mol SO3ЃЌДяЕНЦНКтЪБЛьКЯЦјЬхЕФбЙЧПБШЦ№ЪМЪБдіДѓСЫ10%ЃЛШєПЊЪМЪБГфШы2 mol SO2КЭ1 mol O2ЃЌдђДяЕНЦНКтЪБSO2ЕФзЊЛЏТЪЮЊ
A. 20% B. 60% C. 80% D. 90%
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉжиИѕЫсМиЃЈK2Cr2O7ЃЉжївЊгУгкжЦИяЁЂгЁШОЁЂЕчЖЦЕШЃЎЦфЫЎШмвКжаДцдкЦНКтЃКCr2O72Љ+H2O![]() 2CrO42Љ+2H+ЁЃвдИѕЫсМиЃЈK2CrO4ЃЉЮЊдСЯЃЌгУЕчЛЏбЇЗЈжЦБИжиИѕЫсМиЕФЪЕбщзАжУШчЭМ
2CrO42Љ+2H+ЁЃвдИѕЫсМиЃЈK2CrO4ЃЉЮЊдСЯЃЌгУЕчЛЏбЇЗЈжЦБИжиИѕЫсМиЕФЪЕбщзАжУШчЭМ

ЂйаДГівѕМЋЧјЕФЕчМЋЗДгІЪН___________________ЃЌЭИЙ§РызгНЛЛЛФЄЕФРызгЪЧ____________ЃЌвЦЖЏЗНЯђЮЊ____________ЃЈЬюЁАгЩзѓЯђгвЁБЛђЁАгЩгвЯђзѓЃЉЁЃ
ЂкбєМЋЧјФмЕУЕНжиИѕЫсМиШмвКЕФдвђЮЊ_______________________________________________________ЁЃ
ЃЈ2ЃЉЙЄвЕЩЯВЩгУЯТУцЕФЗНЗЈДІРэКЌгаCr2O72-ЕФЫсадЙЄвЕЗЯЫЎЃКЗЯЫЎжаМгШыЪЪСПNaClЃЌвдЬњЮЊЕчМЋНјааЕчНтЃЌгаCr(OH)3КЭFe(OH)3ГСЕэЩњГЩЃЌЙигкЩЯЪіЗНЗЈЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ_______ЃЈЬюзжФИађКХЃЉЁЃ
AЃЎвѕМЋЗДгІЃК2HЃЋЃЋ2eЃ===H2Ёќ
BЃЎбєМЋЗДгІЃКFeЃ3eЃ===Fe3ЃЋ
CЃЎдкЕчНтЙ§ГЬжаЕБЕчТЗзЊвЦ0.6molЕчзгЪБЃЌБЛЛЙдЕФCr2O72-ЮЊ0.05mol
DЃЎПЩвдНЋЬњЕчМЋИФЮЊЪЏФЋЕчМЋ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com