
【题目】已知:邻苯二甲酸(H2A)的Ka1=1.1×10-3,Ka2=3.9×10-6。室温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1邻苯二甲酸氢钾(KHA)溶液。下列说法正确的是( )
A.0.1 mol·L-1 KHA溶液中:c(K+)>c(HA-)+2c(A2-)
B.加入NaOH溶液至pH=8时:c(K+)>c(A2-)>c(HA-)>c(H2A)
C.加入20 mL NaOH溶液时:c(OH-)+c(A2-)=c(Na+)+c(H+)+c(H2A)
D.在滴定过程中,水的电离程度一直减小
【答案】BC
【解析】
A.由题可知常温下![]() ,
,![]() ,因此
,因此![]() ,所以KHA的溶液中HA-的电离程度大于其水解程度,溶液显酸性即:
,所以KHA的溶液中HA-的电离程度大于其水解程度,溶液显酸性即:![]() ,根据KHA溶液中的电荷守恒式:
,根据KHA溶液中的电荷守恒式:![]() ,可得
,可得![]() ,A项错误;
,A项错误;
B.由题可知常温下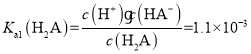 ,
,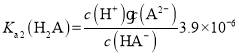 ,pH=8时,
,pH=8时,![]() ,因此可得,
,因此可得,![]() ,
,![]() ,B项正确;
,B项正确;
C.KHA溶液的初始浓度为0.1mol/L,体积为20mL;因此加入20mL,浓度为0.1mol/L的NaOH溶液后,有物料守恒关系式为:![]() ;溶液中的电荷守恒关系式为:
;溶液中的电荷守恒关系式为:![]() ;联立两个式子可得
;联立两个式子可得![]() ,C项正确;
,C项正确;
D.通过分析可知,KHA的溶液中水的电离总体上受抑制,滴定过程中,KHA逐渐转变为A2-,A2-会促进水的电离;因此,滴定过程中水的电离程度逐渐增加,至滴定终点时水的电离程度达到最大,D项错误;
答案选BC。


科目:高中化学 来源: 题型:
【题目】已知一定温度下合成氨反应:N2+3H2![]() 2NH3 (每生成2 mol NH3放出92.4kJ的热量),在恒温、恒压的密闭容器中进行如下实验:①通入1molN2和3mol H2,达平衡时放出热量为Q1,②通入2 molN2和6 molH2,达平衡时放出热量为Q2,则下列关系正确的是
2NH3 (每生成2 mol NH3放出92.4kJ的热量),在恒温、恒压的密闭容器中进行如下实验:①通入1molN2和3mol H2,达平衡时放出热量为Q1,②通入2 molN2和6 molH2,达平衡时放出热量为Q2,则下列关系正确的是
A. Q2=2Q1=184.8kJB. Q1<0.5Q2
C. Q1<Q2<184.8kJD. Q1 =Q2 <92.4kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种固定烟气中CO2的工艺流程如下:
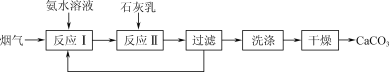
(1) “反应Ⅰ”中,CO2与过量氨水反应的离子方程式为________。
(2) “反应Ⅰ”中,提高烟气中CO2去除率的可行措施有________(填字母)。
a. 采用高温 b. 加快烟气流速 c. 增大氨水浓度
(3) 若测得滤液中c(CO32-)=10-2 mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。[c(Ca2+)<10-5 mol·L-1时视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4) “反应Ⅱ”中,溶液的pH和导电能力变化如图1所示,导电能力初始时快速降低,后来逐渐上升的原因是____________________________________________。
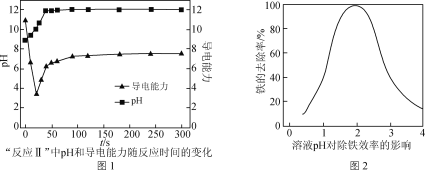
(5) CaCO3可用于调节废水的pH,以除去其中的Fe3+。溶液pH对除铁效率影响如图2所示。
①除铁时应控制溶液的pH为________(填字母)。
a. 0.5~1.5 b. 1.5~2.5 c. 2.5~3.5
② 除铁时pH稍大会生成Fe(OH)3胶体,显著降低除铁效率,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种黄酮类化合物的中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( )
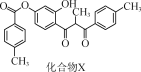
A.分子中所有碳原子共平面
B.分子中存在1个手性碳原子
C.化合物X不能使酸性KMnO4溶液褪色
D.1 mol化合物X最多可与12 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)该反应的热化学方程式为_______________________________________。
(2)又知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________________________。
Ⅱ.参考下列图表和有关要求回答问题。
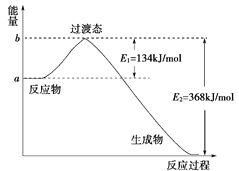
(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________________________;
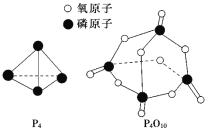
(2)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ/mol) | a | b | c | x |
已知白磷的燃烧热ΔH=-d kJ/mol,白磷及其完全燃烧的产物结构如图所示,则上表中x=______________________(用含有a、b、c、d的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)Si的原子核外价电子排布图为___________________________
(2)金刚石的结构是正四面体则其中的碳原子杂化方式是_______________
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式____________________________;
②CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为__________;
③乙烯的分子是C2H4,是根据其结构推断是_________分子(填 “极性”或“非极性”)
(4)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,CO分子中碳氧键的伸缩振动频率为2143cm-1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度__________(填字母)
A.强 B.弱 C.相等 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和结论都正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性,能将Fe氧化成Fe3+ |
B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
C | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
D | 向含有酚酞的Na2CO3溶液中加入少量的BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10mL0.1mol/LNa2CO3溶液中逐滴加入0..1mol/LHCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法不正确的是
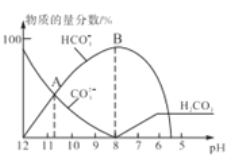
A. 常温下,水解常数Kh(CO32-)的数量级为10-4
B. 当溶液是中性时,溶液的总体积大于20mL
C. 在0.1mol/LNa2CO3溶液中:c(OH-)>c(H2CO3)+c(HCO3-)+c(H+)
D. 在B点所示的溶液中,离子浓度最大的是HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如下,下列说法中,错误的是( )
![]()
A. 操作①发生的反应为非氧化还原反应
B. 若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器
C. 操作②是蒸发浓缩结晶
D. 在整个制备过程中,未发生置换反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com