
(1)现有A、B、C、D、E五种原子序数递增的主族元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;D的单质跟盐酸反应,生成D3+和氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。
① 写出元素符号:A ,C ,E 。
② B、D的最高价氧化物对应水化物相互反应的离子方程式为:
。
③ 写出E2C的电子式: 。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。

① 阴影部分元素N在元素周期表中的位置为第 周期第 族。
根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
② 元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③ Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是________________________________________________。
④ 下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
(12分)(1)①H
S K ②Al(OH)3+OH-=AlO2-+2H2O
③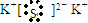
(2)①二 VA H3AsO4<H3PO4 ②4 更小
③H+、Br-、SO42- ④ABD
【解析】
试题分析:(1)①氢元素的氢-1原子核中只有1个质子,没有中子,依题意可知,A是氢(或H);由于元素的原子序数=原子的质子数,同周期主族元素的原子半径随原子序数增大而减小,设B的原子序数为x,则C的原子序数为x+5,依题意可知,x+x+5=27,则x=11,x+5=16,则B是钠(或Na),C是硫(或S);由于2Al+6H+=2Al3++3H2↑,依题意可知,D是铝(或Al);硫元素的最低负价为—2,S2-具有288电子层结构,依题意可知E的最高正价为+1,K+也具有288电子层结构,则E是钾(或K);B、D分别是钠、铝,最高价氧化物对应水化物分别是氢氧化钠、氢氧化铝,NaOH是强碱,Al(OH)3是两性氢氧化物,二者容易反应,生成偏铝酸钠和水,NaAlO2是易溶易电离物,水是弱电介质,则该反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;③E、C分别是钾、硫,分别是活泼金属、活泼非金属,钾原子容易失去最外层的1个电子变为钾离子,硫原子容易得到2个电子变为硫离子,2个钾离子和1个硫离子之间以离子键结合成离子化合物,则K2S的电子式为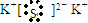 ;(2)①氮原子具有25电子层结构,由于原子的电子层数=元素的周期序数,原子的最外层电子数=元素的主族序数,则氮元素位于第二周期第VA族;从上到下,同主族非金属元素的非金属性递减,则As的非金属性小于P,由于非金属性越强,最高价氧化物对应水化物酸性越强,则酸性:H3AsO4<H3PO4;硫原子具有286的电子层结构,由于元素的最高正价=原子的最外层电子数,则硫元素的最高正价为+6,由于主族非金属元素的最低负价=最高正价—8(除氢外),则硫元素的最低负价为—2,+6+(—2)=+4;②由于S的非金属行比Se强,非金属性越强,单质与氢气化合生成气态氢化物越容易,则在相同条件下Se与H2反应的限度比S与H2反应限度更小;③根据氧化还原反应中强弱规律可得,SO2+Br2+2H2O=H2SO4+2HBr,硫酸、氢溴酸是强酸,则生成物完全电离出氢离子、硫酸根离子、溴离子,所以二氧化硫气体通入溴水后溶液中主要存在的离子是H+、Br-、SO42-;④C、N、O、F是第二周期中原子序数增大的元素,电子层数相同,原子半径随原子序数增大而减小,故A正确;Si、P、S、Cl是第三周期中原子序数增大的元素,同周期主族元素的非金属性随核电荷数增大而增强,故B正确;干冰是固态二氧化碳,其升华是固态二氧化碳直接变为二氧化碳气体的过程,没有新物质生成,属于物理变化,液态水变为水蒸气属于水的气化,也没有新物质生成,属于物理变化,因此都不需要克服分子内的共价键,只需要克服分子间作用力,故C错;F、Cl、Br、I是第VIIA族元素,同主族元素非金属性随原子序数递增而减弱,则非金属性:F>Cl>Br>I,非金属性越强,气态氢化物越稳定,则稳定性:HF>HCl>HBr>HI,故D正确。
;(2)①氮原子具有25电子层结构,由于原子的电子层数=元素的周期序数,原子的最外层电子数=元素的主族序数,则氮元素位于第二周期第VA族;从上到下,同主族非金属元素的非金属性递减,则As的非金属性小于P,由于非金属性越强,最高价氧化物对应水化物酸性越强,则酸性:H3AsO4<H3PO4;硫原子具有286的电子层结构,由于元素的最高正价=原子的最外层电子数,则硫元素的最高正价为+6,由于主族非金属元素的最低负价=最高正价—8(除氢外),则硫元素的最低负价为—2,+6+(—2)=+4;②由于S的非金属行比Se强,非金属性越强,单质与氢气化合生成气态氢化物越容易,则在相同条件下Se与H2反应的限度比S与H2反应限度更小;③根据氧化还原反应中强弱规律可得,SO2+Br2+2H2O=H2SO4+2HBr,硫酸、氢溴酸是强酸,则生成物完全电离出氢离子、硫酸根离子、溴离子,所以二氧化硫气体通入溴水后溶液中主要存在的离子是H+、Br-、SO42-;④C、N、O、F是第二周期中原子序数增大的元素,电子层数相同,原子半径随原子序数增大而减小,故A正确;Si、P、S、Cl是第三周期中原子序数增大的元素,同周期主族元素的非金属性随核电荷数增大而增强,故B正确;干冰是固态二氧化碳,其升华是固态二氧化碳直接变为二氧化碳气体的过程,没有新物质生成,属于物理变化,液态水变为水蒸气属于水的气化,也没有新物质生成,属于物理变化,因此都不需要克服分子内的共价键,只需要克服分子间作用力,故C错;F、Cl、Br、I是第VIIA族元素,同主族元素非金属性随原子序数递增而减弱,则非金属性:F>Cl>Br>I,非金属性越强,气态氢化物越稳定,则稳定性:HF>HCl>HBr>HI,故D正确。
考点:考查位、构、性的综合推断,涉及元素符号的推断、最高价氧化物对应水化物之间反应的离子方程式、离子化合物的电子式、元素的位置、最高价氧化物对应水化物酸性强弱、主族非金属元素的最高正价和最低负价、非金属单质与氢气化合的难易、氧化还原反应、强酸的电离、同周期主族元素原子半径大小比较、非金属性强弱比较、物理变化、化学变化、化学键、同主族非金属元素气态氢化物的稳定性等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 填空 (1)现有A、B、C三种烃,其球棍模型如图:
填空 (1)现有A、B、C三种烃,其球棍模型如图: ;⑥
;⑥

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
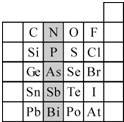 (1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.
(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.

查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省实验中学高一下学期期末考试化学试卷(带解析) 题型:填空题
(12分)
(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5; D的单质跟盐酸反应,生成D3+和氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。
①写出元素符号:
A ,C ,E 。
② B、D的最高价氧化物对应水化物相互反应的离子方程式为:
。
③写出E2C的电子式: 。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
①阴影部分元素N在元素周期表中的位置为第 周期第 族。
根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
②元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③ Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是________________________________________________。
④下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源:2014届广东省高一下学期期末考试化学试卷(解析版) 题型:推断题
(12分)
(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5; D的单质跟盐酸反应,生成D3+和氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。
① 写出元素符号:
A ,C ,E 。
② B、D的最高价氧化物对应水化物相互反应的离子方程式为:
。
③ 写出E2C的电子式: 。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
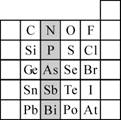
① 阴影部分元素N在元素周期表中的位置为第 周期第 族。
根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
② 元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③ Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是________________________________________________。
④ 下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com