
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| CO | Cl2 | COCl2 | COCl2 | ||
| Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
| Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
| Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
| A. | 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol•L-1•min-1 | |
| B. | 该反应正反应为吸热反应 | |
| C. | 容器Ⅱ中起始时Cl2的物质的量为0.55 mol | |
| D. | 若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率大于80% |
分析 A.依据v=$\frac{△c}{△t}$计算用COCl2表示的反应速率,依据速率之比等于计量系数之比计算用CO表示速率;
B.Ⅱ和Ⅲ为等效平衡,依据温度改变后COCl2物质的量判断反应的热效应;
C.依据Ⅰ组数据计算反应平衡常数,Ⅰ和Ⅱ温度相同则平衡常数相同,依据平衡常数计算容器Ⅱ中起始时Cl2的物质的量;
D.CO(g)+Cl2(g)?C0Cl2(g)为气体体积减小的反应,减压平衡向系数大的方向移动;
解答 解:A.容器I中前5min的平均反应速率v(COCl2)=$\frac{\frac{0.8mol}{0.5L}}{5min}$=0.32mol/L•Min-1,依据速率之比等于计量系数之比,则V(CO)=V(COCl2)=0.32mol/L•Min-1,故A错误;
B.依据图中数据可知:Ⅱ和Ⅲ为等效平衡,升高温度,COCl2物质的量减小,说明平衡向逆向移动,则逆向为吸热反应,正向为放热反应,故B错误;
C.依据方程式:CO(g)+Cl2(g)?C0Cl2(g),可知:
CO(g)+Cl2(g)?C0Cl2(g),
起始浓度(mol/L) 2 2 0
转化浓度(mol/L) 1.6 1.6 1.6
平衡浓度(mol/L) 0.4 0.4 1.6
反应平衡常数K=$\frac{1.6}{0.4×0.4}$=10,平衡时CO转化率:$\frac{1.6mol/L}{2mol/L}$×100%=80%;
依据Ⅱ中数据,结合方程式可知:
CO(g)+Cl2(g)?C0Cl2(g),
起始浓度(mol/L) 2 2a 0
转化浓度 (mol/L) 1 1 1
平衡浓度 (mol/L) 1 2a-1 1
Ⅰ和Ⅱ温度相同则平衡常数相同则:K=$\frac{1}{1×(2a-1)}$=10,解得:a=0.55mol,故C正确;
D.CO(g)+Cl2(g)?C0Cl2(g)为气体体积减小的反应,若起始时向容器I加入CO0.8mol,Cl20.8mol,相当于给体现减压,减压平衡向系数大的方向移动,平衡转化率降低,小于80%,故D错误;
故选C.
点评 本题考查化学平衡的计算,题目难度中等,涉及化学反应速率、化学平衡常数的计算及应用,熟悉平衡常数计算公式及化学平衡移动影响因素是解题关键,注意掌握三段式在化学平衡计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
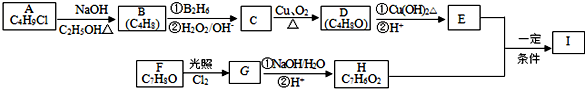
 ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 碳原子数(n) | 6 | 8 | 10 | 12 | … |
| 结构简式 | 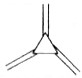 | 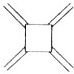 | 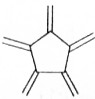 | 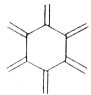 | … |
| A. | 轴烯的通式可表示为CnHn | |
| B. | n=100的轴烯分子中含有50个碳碳双键 | |
| C. | n=6的轴烯分子的同分异构体中含有两个碳碳三键的结构有6种 | |
| D. | n=8的轴烯分子的同分异构体可能属于芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | RO | B. | R2Om | C. | R2Om-n | D. | R2O2m-n |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
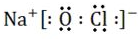 .
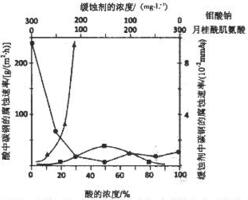
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
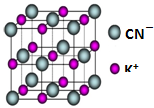 目前工业上制备丙烯腈(CH2=CHC≡N)有乙炔法、丙烯氨氧化法等.
目前工业上制备丙烯腈(CH2=CHC≡N)有乙炔法、丙烯氨氧化法等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
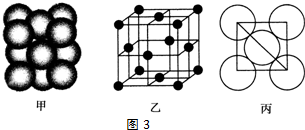
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com