
【题目】下列说法中正确的是
A.在粗铜的精炼过程中,若电路中转移1 mol 电子,则阳极质量一定减少了32 g
B.反应8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) ΔH<0,则该反应一定能自发进行
C.1.2g的金刚石和12g 的SiO2分别含有0.4mol的C-C键与0.4mol 的Si-O 键
D.常温下,向NH4Cl溶液中加入少量NaOH固体(溶液温度没有变化),溶液中![]() 的值增大
的值增大
【答案】BD
【解析】
A、粗铜中含有杂质锌、铁,锌、铁先失电子变为Zn2+、Fe2+进入溶液中,电路中转移1 mol 电子,锌溶解了32.5g,铁溶解了28g,阳极质量减少了,但不一定是32 g,故A错误;
B、根据反应自发进行的判断根据是ΔH-TS<0 分析,8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) ΔH<0,S>0,一定存在ΔH-TS<0,则该反应一定能自发进行,故B正确;
C. 1.2g的金刚石的物质的量为0.1mol,12g 的SiO2的物质的量为0.2mol;而1mol金刚石中含2molC-C键,1mol二氧化硅中含4molSi-O键,所以0.1mol的金刚石和0.2mol的SiO2分别含有0.2mol的C-C键与0.8mol 的Si-O 键,故C错误;
D、NH4Cl溶液存在水解平衡,离子方程式:NH4++H2O![]() NH3H2O+H+,向NH4Cl溶液中加入少量NaOH固体,氢氧根离子与氢离子反应,c(H+)减小,平衡右移,根据水解平衡常数可知,
NH3H2O+H+,向NH4Cl溶液中加入少量NaOH固体,氢氧根离子与氢离子反应,c(H+)减小,平衡右移,根据水解平衡常数可知,![]() =
= ![]() ,由于c(H+)减小,所以
,由于c(H+)减小,所以![]() 增大,故D正确;
增大,故D正确;
故答案选BD。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】工业上利用氧化铝基废催化剂(主要成分为Al2O3,还含有少量Pd(钯)))回收硫酸铝及Pd的流程如下:
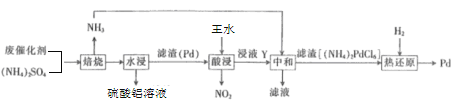
回答下列问题:
(1)将硫酸铝溶液蒸发浓缩后,冷却得到十八水合硫酸铝固体,该固体的化学式为___。
(2)焙烧时Al2O3与(NH4)2SO4反应的化学方程式为___。
(3)王水是浓硝酸和浓盐酸按体积比为___的混合物。王水不稳定,加热时能生成亚硝酰氯(NOCl)和氯气,该反应的化学方程式为___。
(4)浸液Y中含Pd元素的溶质是H2PdCl6(氯钯酸),则“酸浸”时反应的化学方程式为___。
(5)若“热还原”中得到的固体只有Pd,每生成1molPd时生成的气体的物质的量为___。
(6)Pd是优良的储氢金属,其储氢原理为2Pd(s)+xH2(g)═2PdHx(s),其中x的最大值为0.8。已知:Pd的密度为12gcm﹣3,则21.2cm3Pd能储存标准状况下H2的最大体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质不能实现直接转化的是( )
A.C→CO2→NaHCO3→Na2CO3
B.Al→Al(OH)3→Al2O3→NaAlO2
C.Na→NaOH→Na2CO3→NaHCO3
D.Na→Na2O2→Na2CO3→NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.中性溶液中:Fe3+、NH4+、Br、HCO3-
B.澄清透明的溶液中:Na+、Cu2+、NO3-、Cl-
C.c(OH-)<![]() 的溶液中:Na+、Ca2+、ClO-、F-
的溶液中:Na+、Ca2+、ClO-、F-
D.1mo/L的KNO3溶液中:H+、Fe2+、SCN-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物的水溶液中,只可能含有以下离子中的若干种:K+、Mg2+、Fe3+、NH![]() 、Cl-、CO
、Cl-、CO![]() 和SO
和SO![]() 。现每次取10.00 mL进行实验:
。现每次取10.00 mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体0.672 L (标准状况下);
③第三份加足量BaCl2溶液后得干燥沉淀6.63 g,沉淀经足量盐酸洗涤,干燥后剩4.66 g。
请回答:
(1) c(CO![]() )=____mol·L-1。
)=____mol·L-1。
(2) K+是否存在?_______;若存在,浓度范围是_____(若不存在,则不必回答)。
(3) 根据以上实验:
①不能判断哪些离子是否存在________________;
②若存在这些离子,如何进行检验?_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 比较Cl2与H2SO4氧化性强弱 | 向漂白粉中加入4mol·L-1硫酸,观察有无黄绿色气体 |
B | 向浓度均为0.10molL-1的KCl和KI混合溶液中滴加少量AgNO3稀溶液,出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
C | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3- |
D | 向苯酚钠溶液中通入CO2,溶液变浑浊 | 结合H+能力: C6H5O->CO32- >HCO3- |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是合成一种天然茋类化合物的重要中间体,其合成路线如下:
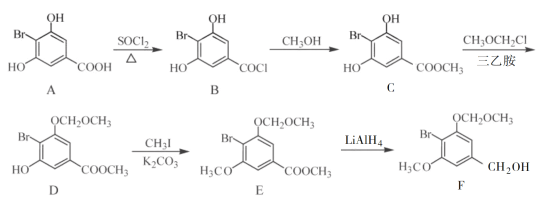
(1)E中含氧官能团的名称为________和________。
(2)B→C的反应类型为________。
(3)C→D反应中会有副产物X(分子式为C12H15O6Br)生成,X的结构简式为:________。反应D→E的方程式为______________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②碱性水解后酸化,含苯环的产物分子中不同化学环境的氢原子数目比为1∶1。
(5)已知: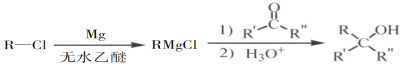 (R表示烃基,R'和R"表示烃基或氢),写出以
(R表示烃基,R'和R"表示烃基或氢),写出以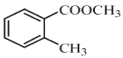 和CH3CH2CH2OH为原料制备的
和CH3CH2CH2OH为原料制备的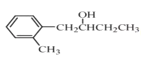 合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。____________________
合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个真空恒容密闭容器中盛有1molPCl5,加热到200℃时发生如下反应:PCl5(气) ![]() PCl3(气)+Cl2(气),反应达到平衡时,混合气体中PCl5所占体积分数为M%. 若在同一温度和同一容器中,最初投入是2molPCl5,反应达平衡时,混合气体中PCl5所占体积分数为N%.则M和N的关系 ( )
PCl3(气)+Cl2(气),反应达到平衡时,混合气体中PCl5所占体积分数为M%. 若在同一温度和同一容器中,最初投入是2molPCl5,反应达平衡时,混合气体中PCl5所占体积分数为N%.则M和N的关系 ( )
A. 大于B. 小于C. 等于D. 不能肯定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.
已知该反应中H2O2只发生如下过程:H2O2―→O2.
①该反应中的还原剂是____________.
②该反应中,发生还原反应的过程是____________→____________.
③写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目_______
④如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为____________
(Ⅱ)已知实验室利用KMnO4溶液和浓盐酸反应制取Cl2,请回答下列问题:
①配平此化学方程式:
____KMnO4+____HCl(浓)— ____KCl+____MnCl2+____Cl2↑+____H2O
②把此化学方程式改写成离子方程式: ________
③被氧化的HCl 与未被氧化的HCl物质的量之比为____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com