
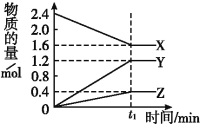
����Ŀ����.ij�¶���,��2 L������3�����ʼ���з�Ӧ,X��Y��Z�����ʵ�����ʱ��ı仯������ͼ����Ӧ��t1 minʱ����ƽ��,��ͼ��ʾ:
��1���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��2������������Ӧ��X��Y��Z�ֱ�ΪNH3��H2��N2,����֪1 mol �����ֽ�ɵ���������Ҫ����46 kJ������,����t1 minʱ,�÷�Ӧ���յ�����Ϊ ;�ڴ�t1 minʱ����,��H2��ʾ��Ӧ��ƽ������v��H2��Ϊ ��
��. �������ƺ͵������������Һ�ﷴӦ�Ļ�ѧ����ʽ�ǣ�
5Na2SO3+2KIO3+H2SO4 ===5Na2SO4+K2SO4+I2+H2O��
�÷�Ӧ���̺ͻ����ϸ��ӣ�һ����Ϊ��Ϊ���¼�����
��IO3-+SO32-��IO2-+SO42-������
��IO2-+2SO32-��I-+2SO42-���죩
��5I-+6H++IO3-��3I2+3H2O������
��I2+SO32-+H2O��2I-+SO42-+2 H+������
��1���������������Ʋ⣬�˷�Ӧ���ܵķ�Ӧ������ ����Ӧ����������١��ڡ��ۡ��ܡ�����
��2����Ԥ�ȼ��������Һ����������,������ ����������ʱ���Ż�ʹ���۱��������������
���𰸡���.��1��2X![]() 3Y+Z
3Y+Z
��2��36.8 kJ��![]() mol/��L��min��
mol/��L��min��
��. ��1����
��2��SO32-
��������
�����������.��1����ͼ����Կ�����X�����ʵ�����С����XΪ��Ӧ�Y��Z�����ʵ��������࣬��ΪY��ZΪ���������Ӧ����2minʱ����n��X��=0.8mol����n��Y��=1.2mol����n��Z��=0.4mol����ѧ��Ӧ�У������ʵ����ʵ����ı仯ֵ�뻯ѧ�����������ȣ����n��X������n��Y������n��Z��=2��3��1�����Է�Ӧ�Ļ�ѧ����ʽΪ��2X![]() 3Y+Z��
3Y+Z��
�ʴ�Ϊ��2X![]() 3Y+Z��
3Y+Z��
��2����������Ӧ��X��Y��Z�ֱ�ΪNH3��H2��N2������֪1 mol �����ֽ�ɵ���������Ҫ����46 kJ������������t1 minʱ����ͼ���֪�����ֽ�İ��������ʵ���Ϊ0.8mol���÷�Ӧ���յ�����Ϊ46��0.8=36.8 ��kJ���ڴ�t1 minʱ��������H2��ʾ��Ӧ��ƽ������v��H2��Ϊ![]() mol/��L��min����
mol/��L��min����
�ʴ�Ϊ��36.8 kJ��![]() mol/��L��min����
mol/��L��min����
��. ��1��������Ӧ����������Ӧ���̵����ʣ���Ӧ�����IJ������Тٲ��������������dz�Ѹ�٣��ʷ�Ӧ�����ɢٲ���Ӧ������
�ʴ�Ϊ���٣�
��2���ɷ�Ӧ�ܿ�֪��SO32-�Ļ�ԭ�Դ���I-���ɱ�I2����������������SO32-���Ż�����I2���Ż�����Һ��
�������������
�ʴ�Ϊ��SO32-��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ�ѧ�������������У���ȷ���ǣ� ��
A�����ӻ�������ܺ����ۼ�
B�����ۻ�������ܺ����Ӽ�
C�����ӻ�������ֻ�����Ӽ�
D�����ۻ������п��ܺ����ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������;��˵����������ʵ����
A��SO2������ɱ�������� B��HF�����ڵ�̲���
C��NH3������������ D��SiO2��������̫���ܵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ʾ���ʱ仯�Ļ�ѧ����ʽ������ȷ����
A����ͭ����ʱ�����Դ�����������Ǵ�ͭ��������ӦʽΪCu��2e���TCu2+
B������ȼ�ϵ�صĸ�����Ӧʽ��O2+2H2O+4e���T4OH��
C���ö��Ե缫��ⱥ��ʳ��ˮʱ�������ĵ缫��ӦʽΪ2Cl����2e���TCl2��
D�����������绯ѧ��ʴ��������Ӧʽ��Fe��2e���TFe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Դ�Ŀ�������ʱ�������ɳ�����չ����Ҫ���⡣������������Դ����
A. ���� B. ú̿ C. ��Ȼ�� D. ʯ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ�������Ǵ�������(��Cr2O72-��CrO42-)��ҵ��ˮ�ij��÷������������£�
![]()
��֪ת�������еķ�ӦΪ2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)��ת����������Һ�и�Ԫ�صĺ���Ϊ28.6g��L��CrO42-��10/11ת��ΪCr2O72-������˵������ȷ����
Cr2O72-(aq)+H2O(l)��ת����������Һ�и�Ԫ�صĺ���Ϊ28.6g��L��CrO42-��10/11ת��ΪCr2O72-������˵������ȷ����
A. ��Һ��ɫ���ֲ��䣬˵���������淴Ӧ�ﵽƽ��״̬
B. �����̷�(FeSO4��7H2O)����ԭ��������1L��ˮ��������Ҫ458.7g
C. ������ת����Ӧ��ƽ�ⳣ��K��1��1014����ת����������Һ��pH��5
D. ������Ksp[Cr(OH)3]��1��10-32��Ҫʹ�������ˮ�е�c(Cr3+)����1��10-5mol��L��Ӧ����Һ��pH��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ע����˫��������ԭ��Ϊ��Ҫ�ɷ�(��ṹ����ͼ)�� ����ԭ���й㷺��ҩ�����á�
����ԭ���й㷺��ҩ�����á�
��֪һ����ԭ���������������ˮ��õ�һ��������A����(������3��ȡ����)��һ����������ӣ�ijС���A���о����£�

��1��������A�����к��еĹ�����Ϊ (д����)��������Ľṹ��ʽΪ ��
��2����Ӧ���ķ�Ӧ����Ϊ ��
��3����Ӧ����1 mol B����1mol C��NaOH�����ʵ��� ��
��4��д��A����B�Ļ�ѧ����ʽ ��
��5��д����������4��������A������ͬ���칹��Ľṹ��ʽ ��
����FeCl3��Һ��ɫ��
��1 mol E������2 mol Na��1 mol NaOH��
��l mol E����������Cu(OH)2��Ӧ����2 mol Cu2O��
��������ֻ��һ�ֻ�ѧ�������⡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ����Ҫ����ԭ�ϣ��������һ������ʯ�ͻ���ˮƽ�ı�־��ͨ��ʯ���ѽ���Ի����ϩ��������ϩΪԭ�ϻ����Ժϳɺܶ�Ļ�����Ʒ����֪��ϩ�ܷ�������ת����
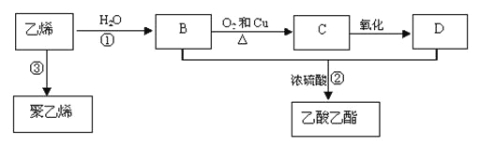
��1����ϩ�Ľṹ��ʽΪ ��
��2����Ӧ���ķ�Ӧ������ ��D�к�����������Ϊ ��
��3��д�����·�Ӧ�Ļ�ѧ����ʽ��[x�� ���� ���� ��
��4����ϩ�������������������飬����������Ҫ�����֣�
����һ��![]()
���ն���![]()
������ɫ��ѧ��ԭ�����������������ԭ�Ӿ����Ժõķ�Ӧ����ʵ�������У�Ӧ����___________����������һ���������ն������������������á�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA��B��C�����������������У���A��B��X������������X��C��������������ʾ��ͼ��������ȷ��ʾ�ܷ�Ӧ�����������仯���ǣ� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com