
| 一定条件 |
| ||
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
A、 -OH与 -OH与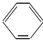 -CH2OH互为同系物 -CH2OH互为同系物 |
| B、乙醇和乙醚互为同分异构体 |
| C、乙醇、乙二醇、丙三醇互为同系物 |
| D、可用浓溴水来区分乙醇苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
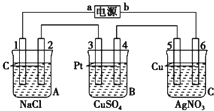 如图,通电5min后,电极5质量增加2.16g,回答:
如图,通电5min后,电极5质量增加2.16g,回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.查看答案和解析>>
科目:高中化学 来源: 题型:
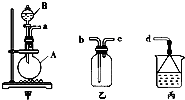 化学是一门以实验为基础的科学,熟练使用中学化学实验中的常见仪器,熟悉常见实验用品是正确进行实验的基础.试回答以下问题:
化学是一门以实验为基础的科学,熟练使用中学化学实验中的常见仪器,熟悉常见实验用品是正确进行实验的基础.试回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ) 4种有机物分别在一定条件下与H2充分反应.
) 4种有机物分别在一定条件下与H2充分反应. 有如下性质:
有如下性质:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com