
| A. | 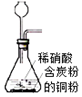 用装置制取NO | |
| B. |  用装置收集NO | |
| C. | 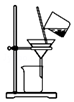 用装置分离炭粉和硝酸铜溶液 | |
| D. |  用装置蒸干硝酸铜溶液制Cu(NO3)2•3H2O |
分析 A.生成气体从长颈漏斗逸出,且NO易被氧化;
B.NO不能用排空气法收集;
C.炭粉不溶于水,硝酸铜溶于水;
D.蒸发时促进铜离子水解,生成硝酸易挥发.
解答 解:A.生成气体从长颈漏斗逸出,且NO易被氧化,则不能制备NO,应选分液漏斗,故A错误;
B.NO不能用排空气法收集,应选排水法收集,故B错误;
C.炭粉不溶于水,硝酸铜溶于水,则利用图中过滤装置可分离,故C正确;
D.蒸发时促进铜离子水解,生成硝酸易挥发,则蒸发不能制备,应选冷却结晶法,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、气体的制备和收集、盐类水解为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将所得氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 向所得氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应至少产生一种酸性强于碳酸的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1 mol•L-1CH3COOH溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 在0.l mol•L-1的稀硫酸加水稀释的过程中,c(H+):c(SO42-)始终为2:1 | |
| C. | 向10 mL浓度为0.l mol•L-1CH3COOH溶液中滴加相同浓度的氨水至中性,在滴加过程中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$逐渐减小 | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)<c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78g苯中含有C=C键的数目为3NA | |
| C. | 7.8gNa2O2固体中含有的离子总数为0.3NA | |
| D. | 标准状况下,将分子总数为NA的NO和O2充分混合后,所得混合气体的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
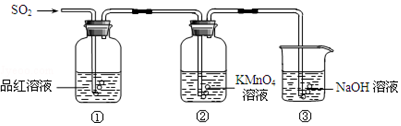
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 | 温度/℃ | 0.1mol•L-I Na2S2O3/mL | 0,1mol•L-1 H2SO4/mL | 水/mL |
| A | 30 | 10 | 10 | 0 |
| B | 30 | 5 | 5 | 10 |
| C | 25 | 10 | 5 | 5 |
| D | 25 | 5 | 10 | 5 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
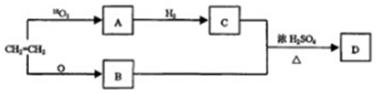
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定温度压强下,将H2和N2充入一体积为2L的密闭容器中.反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是( )
在一定温度压强下,将H2和N2充入一体积为2L的密闭容器中.反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是( )| A. | 从曲线可以看出,反应进行到10 min时,改变的条件可能是降低温度 | |
| B. | 反应开始到第一次平衡,NH3的平均反应速率为0.005 mol/(L min) | |
| C. | 从曲线可以看出,反应进行到25min时,改变的条件是分离出0.1mol的氨气 | |
| D. | 在25 min时平衡正向移动但达到新平衡后NH3的物质的量百分含量比原来小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com