
| A. | ①②③④ | B. | ②③④ | C. | ②③④⑤ | D. | 全部 |
分析 既能与稀H2SO4反应,又能与NaOH溶液反应的物质有铝、氧化铝、氢氧化铝、多元弱酸的酸式盐,弱酸对应的铵盐、蛋白质、氨基酸等.
解答 解:①NaHCO3属于弱酸酸式盐,与稀H2SO4反应生成硫酸钠、水和二氧化碳,与NaOH溶液反应生成碳酸钠和水,故①正确;
②Al2O3属于两性氧化物,与稀H2SO4反应生成硫酸铝和水,与NaOH溶液反应生成偏铝酸钠和水,故②正确;
③Al(OH)3属于两性氢氧化物,与稀H2SO4反应生成硫酸铝和水,与NaOH溶液反应生成偏铝酸钠和水,故③正确;
④Al与稀H2SO4反应生成硫酸铝和氢气,与NaOH溶液反应生成偏铝酸钠和氢气,故④正确;
⑤(NH4)2CO3属于弱酸的铵盐,与稀H2SO4反应生成硫酸铵、水和二氧化碳,与NaOH溶液反应生成碳酸钠、氨气与水,故⑤正确;
故选D.
点评 本题考查元素化合物性质,难度不大,注意归纳总结中学常见能与酸、碱反应的物质.


科目:高中化学 来源: 题型:解答题
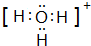 ;
;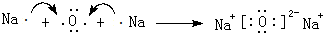 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(h) | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加稀硝酸,沉淀不溶解 该溶液中一定含有SO42- | |
| B. | 向某溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀生成 该溶液中一定含有SO42- | |
| C. | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体 该溶液一定含有CO32- | |
| D. | 向某溶液中加入NaOH浓溶液并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体 该溶液中一定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | SO2+2H2S═3S+2H2O | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | NaOH+HCl═NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空:
核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水、酒精和水、苯酚和水 | |
| B. | 二溴乙烷和水、溴苯和水、硝基苯和水 | |
| C. | 甘油和水、乙醛和水、乙酸和乙醇 | |
| D. | 乙酸和水、甲苯和水、己烷和水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com