
向淀粉溶液中加少量稀H2SO4、加热使淀粉水解,为测其水解程度,需要的试剂是( )
①NaOH溶液 ②银氨溶液 ③新制的Cu(OH)2悬浊液 ④碘水.
|
| A. | ④ | B. | ②④ | C. | ①③④ | D. | ③④ |
考点:
蔗糖与淀粉的性质实验.
分析:
淀粉在一定条件下水解程度可能有三种情况:(1)水解完全,只有葡萄糖;(2)部分水解,残留物中有未水解的淀粉和生成的葡萄糖;(3)没有水解,残留物中只有未水解的淀粉.要检验水解产物中的葡萄糖,必须先用氢氧化钠溶液中和掉做催化剂的硫酸.
解答:
解:淀粉的水解程度包括完全水解和部分水解,其中碘水可检验淀粉是否完全水解,银氨溶液或新制氢氧化铜悬浊液可检验淀粉是否发生水解,但葡萄糖与银氨溶液或新制氢氧化铜悬浊液的反应均须在碱性条件下进行,故在加银氨溶液或新制氢氧化铜悬浊液之前必须先加碱中和,所以需要的试剂有①③④或①②④,故答案为:C.
点评:
本题主要考查淀粉水解程度的检验,难度不大,注意葡萄糖的特征反应即为醛基的性质,检验醛基要在碱性环境下.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
有一未知的无色溶液,只可能含有以下离子中的若干种:H+、NH+4、K+、Mg2+、Cu2+、Al3+、NO﹣3、CO32﹣、SO42﹣,现取三份100mL溶液进行如下实验
①第一份加足量AgNO3溶液后,有白色沉淀产生.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g.
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.
根据上述实验,以下推测不正确的是( )

A. 原溶液一定不存在H+、Cu2+、CO32﹣
B. 不能确定原溶液是否含有K+、NO3﹣
C. 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n(NH4+)=1:1:2
D. 实验所加的NaOH的浓度为2 mol•L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)传统哈伯法合成氨工艺中,
①升高温度,正反应速率(V正) (填“增大”、“减小”或“不变”).
②若增大压强,N2的转化率 ;若已达平衡后再加入N2,N2的转化率减小(填“增大”、“减小”或“不变”).
③若加压到10×101.3KPa时,其它条件不变,发现平衡逆向移动,原因应该是
A.由于体积变大了,反应朝着体积增大方向移动
B.由于N2状态发生了变化
C.由于体积变小了,反应朝着体积增大方向移动
D.由于N2和H2的状态都发生了变化
E.由于H2状态发生了变化,N2状态可能发生变化也可能没有变化
④如图表示上述反应在某一时间段中反应速率与反应过程的关系图.由图判断,NH3的百分含量最高的一段时间是 .
⑤据图判断反应在t2~t3这段时间内,曲线变化的原因是D,t5~t6时间内曲线变化的原因可能是B(以上均填编号).
A.加了催化剂 B.扩大容器的体积 C.降低温度 D.增大压强
⑥不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见表(N2和H2的起始物质的量之比为1:3 ).分析表中数据,200℃100MPa时H2转化率最高.
实际工业生产不选用该条件的主要原因是 .
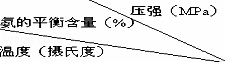 0.1 10 20 30 60 100
0.1 10 20 30 60 100
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.2 52.0 64.2 71.0 84.2 92.6
400 0.4 25.1 38.2 47.0 65.2 79.8
500 0.1 10.6 19.1 26.4 42.2 57.5
600 0.05 4.5 9.1 13.8 23.1 31.4
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.它既有液氢燃料电池的优点,又克服了液氢不易保存的不足.其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2═2N2+6H2O.写出负极电极反应式 ,你认为电解质溶液应显 (填“酸性”、“中性”、“碱性”),其原因是 .

查看答案和解析>>
科目:高中化学 来源: 题型:
300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构式为
(1)用没食子酸制造墨水主要利用了________类化合物的性质(填代号)。
A.醇 B.酚 C.油脂 D.羧酸
(2)没食子酸丙酯具有抗氧化作用,是目前广泛应用的食品添加剂,其结构简式为______________。
(3)尼泊金酯是对羟基苯甲酸与醇形成的酯类化合物,是国家允许使用的食品防腐剂。尼泊金丁酯的分子式为__________,其苯环只与-OH和-COOR两类取代基直接相连的同分异构体有________种。
(4)写出尼泊金乙酯与氢氧化钠溶液加热反应的化学方程式:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是( )
|
| A. | 乙醛与银氨溶液水浴共热,发生还原反应得到光亮如镜的银 |
|
| B. | 苯乙烯与氢气在合适条件下,发生加成反应生成乙基环己烷 |
|
| C. | 乙醇与浓硫酸共热迅速升温至140℃时,发生消去反应生成乙烯 |
|
| D. | 甲苯与氯气在光照下,发生取代反应主要生成2,4二氯甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
1791年,法国医生路布兰首先获得制碱专利,以食盐、浓硫酸、石灰石、煤为原料制碱,该方法分三步:
①用NaCl与H2SO4反应制Na2SO4:2NaCl+H2SO4═Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S:Na2SO4+4C═Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3:Na2S+CaCO3═Na2CO3+CaS
下列说法正确的是( )
|
| A. | ②③两步都是氧化还原反应 |
|
| B. | 只有第②步是氧化还原反应 |
|
| C. | 该方法对生产设备基本没有腐蚀 |
|
| D. | 该方法对环境污染较小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学课外活动小组研究乙醇氧化的实验并验证其产物,设计了甲、乙两套装置(图中的夹持仪器均未画出,“△”表示酒精灯热源),每套装置又可划分为①、②、③三部分.仪器中盛放的试剂为:a﹣无水乙醇(沸点:78℃);b﹣铜丝;c﹣无水硫酸铜;d﹣﹣新制氢氧化铜悬浊液.

(1)两套方案都有各自的优点:简述甲②中的优点: .
(2)集中两套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为、甲②、 (例如甲①,乙②).
(3)若要保证此实验有较高的效率,还需补充的仪器有 .理由是 .
(4)实验中能验证乙醇氧化产物的实验现象是 .
(5)装置中,若撤去第①部分,其他操作不变,则无水硫酸铜无明显变化,其余现象与(4)相同,推断燃烧管中主要反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
A.K+、MnO4﹣、Na+、Cl﹣ B.K+、Na+、NO3﹣、CO32﹣
C.Na+、H+、NO3﹣、SO42﹣ D.Fe3+、Na+、Cl﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
如将物质按照单质、氧化物、酸、
碱、盐分类,下列各组物质中,类别相同的是( )
A.氧气、氧化镁、四氯化碳、水 B.硫酸铜、氯化钠、碳酸钙、硫化钾
C.硫酸、碳酸钠、氯化镁、氧化钠 D.硝酸银、氢氧化钠、醋酸钠、氯化钾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com